药学院蒋晨课题组在三阴性乳腺癌及其转移治疗研究领域取得新进展
近期,复旦大学药学院蒋晨教授课题组开发了一种新型靶向激活血小板的聚合物胶束,并进行了三阴性乳腺癌(TNBC)原发肿瘤和转移瘤治疗相关研究。近日,相关成果以《靶向激活血小板的控释胶束有效治疗原发和转移性三阴性乳腺癌》(Activated Platelets-Targeting Micelles with Controlled Drug Release for Effective Treatment of Primary and Metastatic Triple Negative Breast Cancer)为题,在线发表于《先进功能材料》(Advanced Functional Materials)。
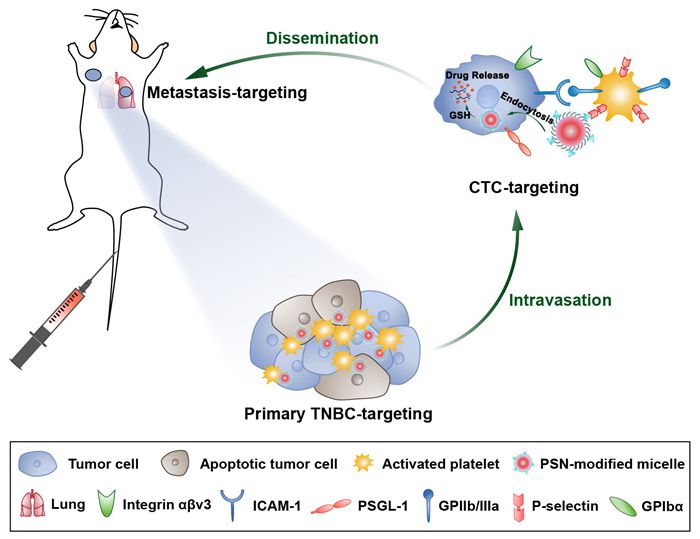
图1胶束搭载激活血小板靶向原发瘤并追踪肿瘤转移的过程示意图
TNBC是指雌激素受体 (ER)、孕激素受体 (PR)和人表皮生长因子受体 (HER2)表达均为阴性的乳腺癌亚型,易复发和转移到远处器官组织 (肺、肝,骨和脑),致死率高。传统的小分子抑制剂在临床上对TNBC患者的治疗效果很差。因此,亟需设计和开发新型的给药策略以改善的治疗效果。
目前,治疗转移性TNBC的研究主要有两种策略:1)在传播前阻止高度侵袭性的循环肿瘤细胞 (CTCs,转移的“种子”)以防止转移的形成;2)靶向已形成的转移灶以杀死转移癌细胞并抑制肿瘤的过度生长。通常,载药纳米颗粒可以通过调控尺寸大小和针对肿瘤处特异性过表达受体来进行表面修饰以靶向肿瘤部位。然而,由于肿瘤的异质性,TNBC进展过程中存在分子表型的改变,靶向肿瘤细胞的纳米颗粒对CTCs和转移灶的特异性和靶向效率可能受到极大挑战。最近的研究表明,血小板可以通过细胞间粘附分子(ICAM)相互作用被肿瘤细胞募集和激活,帮助其进行血管内渗形成CTCs,随后激活的血小板聚集在CTCs周围形成“血小板-CTCs”聚集体并帮助侵袭性CTCs播散至远端器官。因此,针对激活血小板的这种特性,该研究设计并合成了一种P-选择素靶向肽(PSN)修饰的氧化还原响应型胶束,该胶束可以通过PSN与激活血小板膜表面高表达的P-选择素特异性结合,利用激活血小板对肿瘤转移过程的追踪作用,不仅可以在血液循环中捕获CTCs,还可追踪至转移灶或归巢到原发灶(图1)。该胶束在体内搭载激活的血小板,对原发TNBC及其转移灶的靶向性和穿透性显著增强,显著改善了TNBC原发瘤和肺转移的治疗效果。同时,该胶束可以清除循环中的CTCs,有效地抑制了肝转移的发生。该研究对转移性三阴性乳腺癌的全方位治疗提出了新的策略,具有良好的应用前景。
复旦大学药学院博士研究生张宇杰为论文的第一作者,蒋晨教授为论文的通讯作者。该研究获得国家自然科学基金、上海市优秀学术带头人计划和复旦-上海药物所融合基金的支持。
版权与免责声明:本网页的内容由收集互联网上公开发布的信息整理获得。目的在于传递信息及分享,并不意味着赞同其观点或证实其真实性,也不构成其他建议。仅提供交流平台,不为其版权负责。如涉及侵权,请联系我们及时修改或删除。邮箱:sales@allpeptide.com