| 编号: | 168248 |
| 中文名称: | 基质金属蛋白酶MMP substrate、缓激肽[Tyr0]Bradykinin |
| 英文名: | [Tyr0]Bradykinin |
| CAS号: | 33289-76-8 |
| 单字母: | H2N-YRPPGFSPFR-OH |
| 三字母: | H2N N端氨基 -Tyr酪氨酸 -Arg精氨酸 -Pro脯氨酸 -Pro脯氨酸 -Gly甘氨酸 -Phe苯丙氨酸 -Ser丝氨酸 -Pro脯氨酸 -Phe苯丙氨酸 -Arg精氨酸 -OHC端羧基 |
| 氨基酸个数: | 10 |
| 分子式: | C59H82N16O13 |
| 平均分子量: | 1223.38 |
| 精确分子量: | 1222.62 |
| 等电点(PI): | - |
| pH=7.0时的净电荷数: | 3.97 |
| 平均亲水性: | -0.35 |
| 疏水性值: | -1.03 |
| 外观与性状: | 白色粉末状固体 |
| 消光系数: | 1490 |
| 来源: | 人工化学合成,仅限科学研究使用,不得用于人体。 |
| 纯度: | 95%、98% |
| 盐体系: | 可选TFA、HAc、HCl或其它 |
| 生成周期: | 2-3周 |
| 储存条件: | 负80℃至负20℃ |
| 标签: | 酶底物肽(Substrate Peptide) 基质金属蛋白酶底物 缓激肽(Bradykinin) |
Caspase酶对应的底物,Caspases(半胱氨酸天冬氨酸蛋白酶,半胱氨酸依赖性天冬氨酸定向蛋白酶)是一类蛋白酶家族,其功能与凋亡(程序性细胞死亡),坏死和发烧(炎症)的过程密切相关。
什么是胱天蛋白酶?
胱天蛋白酶(Caspases)是含半胱氨酸的天冬氨酸蛋白水解酶,它们是为细胞凋亡的主要介质。多种受体,例如TNF-α 受体,FasL受体,TLR和死亡受体,以及Bcl-2和凋亡抑制剂(IAP)蛋白家族参与并调节该caspase依赖性凋亡途径。一旦Caspase受到上游信号(外部或内在)刺激被激活,即会参与执行下游蛋白底物的水解作用,并触发一系列事件,导致细胞分解,死亡,吞噬作用和细胞碎片的清除。
人Caspases酶
人的Caspases家族基于序列相似性和生物学功能等共性主要可分为三大类:第一类由具有长胱天蛋白酶募集结构域的“炎症”胱天蛋白酶组成,他们对P4位上的较大的芳香族或疏水性残基具有亲和力。第二类由具有短的前体结构域的“细胞凋亡效应”胱天蛋白酶组成,而第三类由具有长的前提结构域的Pap位置具有亮氨酸或缬氨酸底物亲和力的“凋亡引发剂”胱天蛋白酶组成(表1)。
表1. 人胱天蛋白酶的功能分类:
| 细胞死亡途径 | 半胱天冬酶类型 | 酵素 | 物种 |
| 细胞凋亡 | 启动器 | Caspases 2 | 人与鼠 |
| 细胞凋亡 | 启动器 | Caspases 8 | 人与鼠 |
| 细胞凋亡 | 启动器 | Caspases 9 | 人与鼠 |
| 细胞凋亡 | 启动器 | Caspases 10 | 人的 |
| 细胞凋亡 | 效应器 | Caspases 3 | 人与鼠 |
| 细胞凋亡 | 效应器 | Caspases 6 | 人与鼠 |
| 细胞凋亡 | 效应器 | Caspases 6 | 人与鼠 |
| 细胞焦亡 | 炎性的 | Caspases 1 | 人与鼠 |
| 细胞焦亡 | 炎性的 | Caspases 4 | 人的 |
| 细胞焦亡 | 炎性的 | Caspases 5 | 人的 |
启动器Caspase和效应器Caspase酶
根据其在凋亡胱天蛋白酶途径中的作用,胱天蛋白酶可分为两类:启动器和效应器Caspase酶。启动器和效应器Caspas酶都具有由小亚基和大亚基组成的催化位点,Caspase酶的识别位

凋亡启动器Caspase酶,例如caspase-2,-8,-9和-10可以启动caspase激活级联反应。Caspase-8对于形成死亡诱导信号复合物(DISC)是必不可少的,并且在激活后,Caspase-8激活下游效应子Caspase(例如Caspase 3)并介导线粒体中细胞色素c的释放。Caspase-8已被证明对IETD肽序列具有相对较高的底物选择性。凋亡效应胱天蛋白酶例如Caspase-3,-6和-7虽然不负责启动级联途径,但是当被激活时,它们在级联的中间和后续步骤中起着不可或缺的作用。Caspase-3(CPP32 / apopain)是关键效应器,因为它放大了来自启动器Caspase的信号,使用对Caspase-3有选择性的DEVD肽序列对活化的Caspase-3进行检测,可以检测Caspase-3的活性。
Caspase酶底物和抑制剂
Caspase底物和抑制剂由两个关键成分组成:Caspase识别序列和信号产生或蛋白酶抑制基序。不同Caspase识别序列不同,一般由三个或四个氨基酸组成(表2)。Caspase酶识别序列的N端通常有乙酰基(Ac)或碳苯甲氧基(Z)基团修饰,以增强膜的通透性。对应的Caspase识别特定的肽序列为其酶促反应切割位点,释放产生信号或抑制信号的基序。Caspase的显色和荧光底物均以相似的方式起作用,其中底物的信号或颜色强度与蛋白水解活性成正比。
表2. Caspase的底物及其序列
| 多肽 | 氨基酸序列 | 对应的Caspase的种类 |
| IETD | Ile-Glu-Thr-Asp | Caspase 8,颗粒酶B |
| DEVD | Asp-Glu-Val-Asp | Caspase 3、6、7、8或10 |
| LEHD | Leu-Glu-His-Asp | Caspase 9 |
| VAD | Val-Ala-Asp | Caspase 1、2、3、6、8、9或10 |
Caspase酶的显色底物
Caspase的显色底物是有Caspase识别序列及生色基团组成,常见的生色团有pNA(对硝基苯胺或4-硝基苯胺),可使用酶标仪或分光光度计在405 nm处进行光密度检测。
表3. Caspase的显色底物
| 底物 | Caspase | 吸收(nm) | 颜色 |
| Ac-DEVD-pNA * CAS 189950-66-1 * | 半胱天冬酶3 | 405 nm | 黄色 |
| Z-DEVD-pNA | 半胱天冬酶3 | 405 nm | 黄色 |
| Z-IETD-pNA * CAS 219138-21-3 * | 半胱天冬酶8,颗粒酶B | 405 nm | 黄色 |
Caspase的荧光底物
Caspase的荧光底物的结构包含与半胱天冬酶识别相关的荧光团,例如7-氨基-4-甲基香豆素(AMC),7-氨基-4-三氟甲基香豆素(AFC), Rhodamine 110(R110)或ProRed™620。R110的Caspase底物比基于香豆素的Caspase底物(例如AMC和AFC)更敏感,但由于两步裂解过程,其动态范围更窄。 建议将R110标记的Caspase底物用于终点法测定,而将AMC和AFC标记的 Caspase底物用于动力学测定。

图.从左到右,分别是AMC(7-氨基-4-甲基香豆素),AFC(7-氨基-4-三氟甲基香豆素),Rhodamine 110(R110)和ProRed™620的激发和发射光谱。
表4.荧光半胱天冬酶底物。
| 底物名称 | 对应的Caspase | Ex(nm) | Em(nm) | ε¹ | Φ² |
| Ac-DEVD-AFC * CAS 201608-14-2 * | 半胱天冬酶3、7 | 376 | 482 | 17000 | 0.53 |
| Ac-DEVD-AMC * CAS 169332-61-0 * | 半胱天冬酶3、7 | 341 | 441 | 19000 | N / D |
| Z-DEVD-AFC | 半胱天冬酶3、7 | 376 | 482 | 17000 | 0.53 |
| Z-DEVD-AMC * CAS 1135416-11-3 * | 半胱天冬酶3、7 | 341 | 441 | 19000 | N / D |
| Z-DEVD-ProRed™620 | 半胱天冬酶3、7 | 532 | 619 | N / D | N / D |
| (Z-DEVD)2 -R110 * CAS 223538-61-2 * | 半胱天冬酶3、7 | 500 | 522 | 80000 | N / D |
| Z-DEVD-ProRed™620 | 半胱天冬酶3、7 | 532 | 619 | N / D | N / D |
| Ac-IETD-AFC * CAS 211990-57-7 * | 半胱天冬酶8,颗粒酶B | 376 | 482 | 17000 | 0.53 |
| Z-IETD-AFC * CAS 219138-02-0 * | 半胱天冬酶8,颗粒酶B | 376 | 482 | 17000 | 0.53 |
注意:
1.ε=在其最大吸收波长处的摩尔消光系数(单位= cm -1M -1)。
2.Φ=水性缓冲液(pH 7.2)中的荧光量子产率。
Caspase抑制剂
Caspase抑制剂能与Caspase的活性位点结合并形成可逆或不可逆的连接,通常,Caspase抑制剂的结构由Caspase识别序列,诸如醛(-CHO)或氟甲基酮(-FMK)的官能团组成。具有醛官能团的胱天蛋白酶抑制剂是可逆的,而具有FMK的抑制剂是不可逆的。半胱天冬酶底物和抑制剂都具有较小的细胞毒性作用,因此,它们是研究半胱天冬酶活性的有用工具。
表5. 可逆和不可逆的Caspase酶抑制剂
| 抑制剂 | Caspase的种类 | 是否可逆 | Ex(nm) | Em(nm) |
| Ac-DEVD-CHO * CAS 169332-60-9 * | 半胱天冬酶3、7 | 可逆的 | -- | -- |
| Ac-IETD-CHO * CAS 191338-86-0 * | 半胱天冬酶8 | 可逆的 | -- | -- |
| mFluor™450-VAD-FMK | 半胱天冬酶1,2,3,6,8,9,10 | 不可逆的 | 406 | 445 |
| mFluor™510-VAD-FMK | 半胱天冬酶1,2,3,6,8,9,10 | 不可逆的 | 412 | 505 |
| FITC-C6-DEVD-FMK | 半胱天冬酶3、7 | 不可逆的 | 491 | 516 |
| FITC-C6-DEVD-FMK | 半胱天冬酶3、7 | 不可逆的 | 491 | 516 |
| FITC-C6-LEHD-FMK | 半胱天冬酶9 | 不可逆的 | 491 | 516 |
| FITC-C6-LEHD-FMK | 半胱天冬酶9 | 不可逆的 | 491 | 516 |
| FAM-VAD-FMK | 半胱天冬酶1,2,3,6,8,9,10 | 不可逆的 | 493 | 517 |
| SRB-VAD-FMK [磺胺丁胺B-VAD-FMK] | 半胱天冬酶1,2,3,6,8,9,10 | 不可逆的 | 559 | 577 |
定义
基质金属蛋白酶(MMP)属于锌内肽酶家族,统称为metzincins。metzincin超家族的特征是高度保守的基序,该基序包含在催化位点与锌结合的三个组氨酸和位于活性位点下方的保守的蛋氨酸。
发现
间质胶原酶,首先被确定的MMP家族成员,最初是在旨在解释designed变态为青蛙1的胶原重塑的实验中发现的。MMP家族由20多个共享相同功能域的相关锌依赖性酶组成。这些酶既具有通常基于优选底物的描述性名称,又具有基于发现顺序的MMP编号系统1。
结构特征
MMP的基本结构由以下同源结构域组成:1)将MMP引导至分泌或质膜插入途径的信号肽;2)前结构域,通过占据活性位点锌使酶具有潜伏期,使底物难以接近催化酶;3)含锌的催化域;4)溶血毒素域,介导与底物的相互作用并赋予酶特异性;5)连接催化和血红蛋白结构域的铰链区。MMP7或基质溶素是最小的MMP,缺少血红素结构域,但在底物降解中表现出特异性。额外的结构域和底物特异性导致MMP分为亚组。
MMP的蛋白质结构中两个序列基序高度保守。在所有MMP的催化域中发现的共有基序HExGHxxGxxH,包含3个与活性中心的锌离子(Zn)配位的组氨酸。PRCGxPD基序位于MMPs前结构域的C末端;该基因座的半胱氨酸残基(C)与活性中心的锌原子的配位赋予了酶2、3潜伏期。
行动方式
MMP的体内活性在几个水平上受到严格控制。这些酶通常以极低的量表达,其转录受到细胞因子和生长因子(如白介素(IL-1,IL-4,IL-6),转化生长因子(EGF,HGF,TGFβ)的正向或负向严格调控。 ),或肿瘤坏死因子α(TNFα的)4, 5。这些调节分子中的一些可以被MMP蛋白水解激活或失活(反馈作用)。转录后,MMP活性受到位于新合成的酶的N末端的前肽所赋予的潜伏期的限制。从细胞分泌后,MMPs的激活取决于前结构域与催化位点的相互作用的破坏,这可能通过前结构域的构象变化或蛋白水解去除而发生。在其前肽中含有弗林蛋白酶样识别结构域的MMP(MMP11,MT-MMP,MMP28)可以通过枯草杆菌蛋白酶丝氨酸蛋白酶家族的成员在反式高尔基体网络中被激活。MMP14在细胞表面的proMMP2激活中起着不可或缺的作用。分泌的MMP的胞外蛋白水解激活可以通过丝氨酸蛋白酶(如纤溶酶)介导,这暗示着这两个酶基团在ECM重塑中具有相互依赖性。某些活动的MMP可以激活其他proMMP,例如MMP9和MMP1的MMP3激活。激活后,MMP会受到内源性抑制剂,自降解和选择性内吞作用的进一步调节。已经证明通过低密度脂蛋白受体相关蛋白(LRP)机制内吞MMP2、9和137。
功能
MMP参与癌症的各个方面-MMP诱导的肝素结合上皮生长因子,胰岛素样生长因子和成纤维细胞生长因子从细胞表面释放(脱落),促进细胞增殖。另一方面,由MMP释放和激活ECM螯合的TGFβ可以导致细胞增殖受到抑制。
炎症性疾病-许多报道暗示MMP1,MMP3和MMP9参与类风湿和骨关节炎。
心血管疾病-大量研究表明,动脉粥样硬化和动脉瘤形成部位6的MMP,尤其是MMP9水平升高。已经提出MMP代表冠状动脉疾病患者中炎症的敏感标志。
肺部疾病- MMP的水平升高已经牵涉在各种肺部疾病,包括急性呼吸窘迫综合征,哮喘,支气管扩张和囊性纤维化的病理生理学。MMP,EMMPRIN和TIMPs是由肺中的许多常驻细胞产生的,因此使它们在疾病中的作用7的分析变得复杂。
中枢神经系统疾病-在观察到MMP9在类似于多发性硬化症和格林-巴利综合症的动物模型中的关键作用之后,MMPs参与了几种不同类型的神经系统疾病。
休克综合征- MMP8和MMP9存储在多形核白细胞的颗粒。这些细胞是炎症和感染过程中的关键效应器。这些MMP在休克中的作用得到了对MMP9缺陷型小鼠的研究的支持,这些小鼠被证明对内毒素休克具有抗性。Dubois等人[ 8]提出,特定的MMP9抑制作用是治疗败血性休克综合症的一种潜在方法。
参考
1. Gross J, Lapiere CM (1962). Collagenolytic activity in amphibian tissues; a tissue culture assay. PNAS., 48:1014-1022.
2. Nagase H, Woessner F (1999). Matrix metalloproteinases. J Biol Chem., 274(31):21491-21494.
3. Birkedal-Hansen H. (1995). Proteolytic remodeling of extracellular matrix. Curr Opin Cell Biol., 7:728-735.
4. Zucker S, Pei D, Cao J, Lopez-Otin C (2003). Membrane type-matrix metalloproteinases (MT-MMP). Cell Surface Proteases., 54:1-74.
5. Yang Z, Strickland DK, Bornstein P (2001). Extracellular MMP-2 levels are regulated by the low-density lipoprotein-related scavenger receptor and thrombospondin. J Biol Chem., 276: 8403-8408.
6. Van den Steen PE, Dubois B, Nelissen I, Rudd PM, Dwek RA, Opdenakker G (2002). Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9 (MMP-9). Crit Rev Biochem Mol Biol,. 37:376-536.
7. Haseneen N, Vaday G, Zucker S, Foda HD (2003). Mechanical stretch induces MMP-2 release and activation in lung endothelium: role of EMMPRIN. Am J Physio Lung Cell Mol Physiol., 165:541-547.
8. Dubois B, Starckx S, Pagenstecher A, Oord J, Arnold B, Opdenakker G. Gelatinase B (2002). Deficiency protects against endotoxin shock. Eur J Immunol., 32:2163-2171.
Definition
Bradykinin is a nonapeptide that is mainly found in animal preparations that are treated with the venom of the snake, Bothrops jararaca1,2. It dialates blood vessels that in turn leads to decrease in blood pressure2. Bradykinin analogs are slightly modified structural derivatives of bradykinin that perform similar functions as bradykinin3.
Discovery
Bradykinin was discovered in the blood plasma of animals that were treated with the venom from the Brazilian snake, Bothrops jararaca1,2. The discovery was part of a study that was related to toxicology of snake bites. Bradykinin analogs were synthesized by solid-phase techniques in 1975 and their function was studied in rats and rabbits3.
Classification
Bradykinin is a 9 amino acid peptide that belongs to the kinin family of proteins4. It has homologs in several animals including other snakes, frog, dog and humans4.
Structural Characteristics
Bradykinin has the sequence Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg3. Several analogs of bradykinin have been synthesized. They are also nanopeptides containing substitutions of various amino acids of bradykinin. For example two analogs of bradykinin were synthesized one with 7-beta-homo-L-proline and the other with 8-beta-homo-L-phenylalanine substitutions3. It was found that both of them are resistant to enzymatic degradation3.
Mode of action
Bradykinin binds to two different kinin G protein coupled receptors- B1 and B25. Upon binding to these receptors it induces conversion of GTP to GDP which in turn triggers the conversion ATP to cAM which then acts as a second messenger resulting in the activation of genes. B1 receptor is expressed as a result of tissue injury and is found to play a role in inflammation while B2 receptor participates in the vasodilatory role of bradykinin5,6. Bradykinin analogs function is a similar fashion although depending on their structure they might have varying affinities to the receptors compared to bradykinin7. Also analogs of bradykinin have been synthesized that are specific to one of these receptors7.
Functions
Bradykinin is a potent endothelium-dependent vasodilator, causes contraction of non-vascular smooth muscle, increases vascular permeability and also is involved in the mechanism of pain. Bradykinin also causes natriuresis, contributing to a drop in blood pressure8. Bradykinin raises internal calcium levels in neocortical astrocytes causing them to release glutamate9. Overactivation of bradykinin is thought to play a role in a rare disease called Hereditary Angioedema, also known as Hereditary Angio-Neurotic Edema10.
Some analogs of bradykinin have been found to have prolonged hypotensive action compared to bradykinin (Eg: beta-H-Pro-bradykinin)3. Some analogs have relative or even lower potencies compared to bradykinin (Eg: HArg1-Bradykinin and HArg9 Bradykinin)7. Other analogs have been studied for their potential of finding bradykinin antagonists that might be useful in the treatment of angio-neurotic edema.
References
1. Partridge, SM (1948). (Title or abstract not available), Biochem. J., 42, 238.
2. Allen PK, Kusumam J, Yoji S, Yoshitaka N, Berhane G, Sesha R and Michael S (1998). Bradykinin formation: Plasma and tissue pathways and cellular interactions. Clinical reviews in allergy and immunology, 16, 4, 403-429.
3. Ondetti MA, Engel SL (1975). Bradykinin analogs containing beta.-homoamino acid, J. Med. Chem.,18 (7), 761–763.
4. Roseli A, Gomes S, Jair RC, Luis J and Valdemar H (1996). Met-Lys-Bradykinin-Ser, the kinin released from human kininogen by human pepsin. Immunopharmacology, 32, 76-79.
5. Peter GM, Amrita A, and Mauro P (2000). Association between Kinin B1 Receptor Expression and Leukocyte Trafficking across Mouse Mesenteric Postcapillary Venules. J Exp. Med., 192, 367-380.
6. Duchene J, Lecomte F, Ahmed S, Cayla C, Pesquero J, Bader M, Perretti M and Ahluwalia A, (2007). A Novel Inflammatory Pathway Involved in Leukocyte Recruitment: Role for the Kinin B1 Receptor and the Chemokine CXCL5. J Immunol., 179, 4849-4856.
7. Max ES, Phyllis AL (1974). Synthesis and pharmacology of homoarginine bradykinin analog. J. Med. Chem., 17 (11), pp 1227–1228.
8. Dendorfer A, Wolfrum S, Wagemann M, Qadri F, Dominiak P, (2001). Pathways of bradykinin degradation in blood and plasma of normotensive and hypertensive rats. Am J Physiol Heart Circ Physiol., 280:H2182
9. Kuoppala A, Lindstedt KA, Saarinen J, Kovanen PT, Kokkonen JO (2000). Inactivation of bradykinin by angiotensin-converting enzyme and by carboxypeptidase N in human plasma. Am J Physiol Heart Circ Physiol, 278(4):H1069-74.
10. Bas M, Adams V, Suvorava T, Niehues T, Hoffmann TK, Kojda G (2007). Nonallergic angioedema: role of bradykinin. Allergy, 62(8):842-56.
| DOI | 名称 | |
|---|---|---|
| 10.1016/j.jasms.2004.07.016 | Infrared multiphoton dissociation (IRMPD) and collisionally activated dissociation of peptides in a quadrupole ion trap with selective IRMPD of phosphopeptides | 下载 |
| 10.1021/pr100515x | Ultrafast ultraviolet photodissociation at 193 nm and its applicability to proteomic workflows | 下载 |
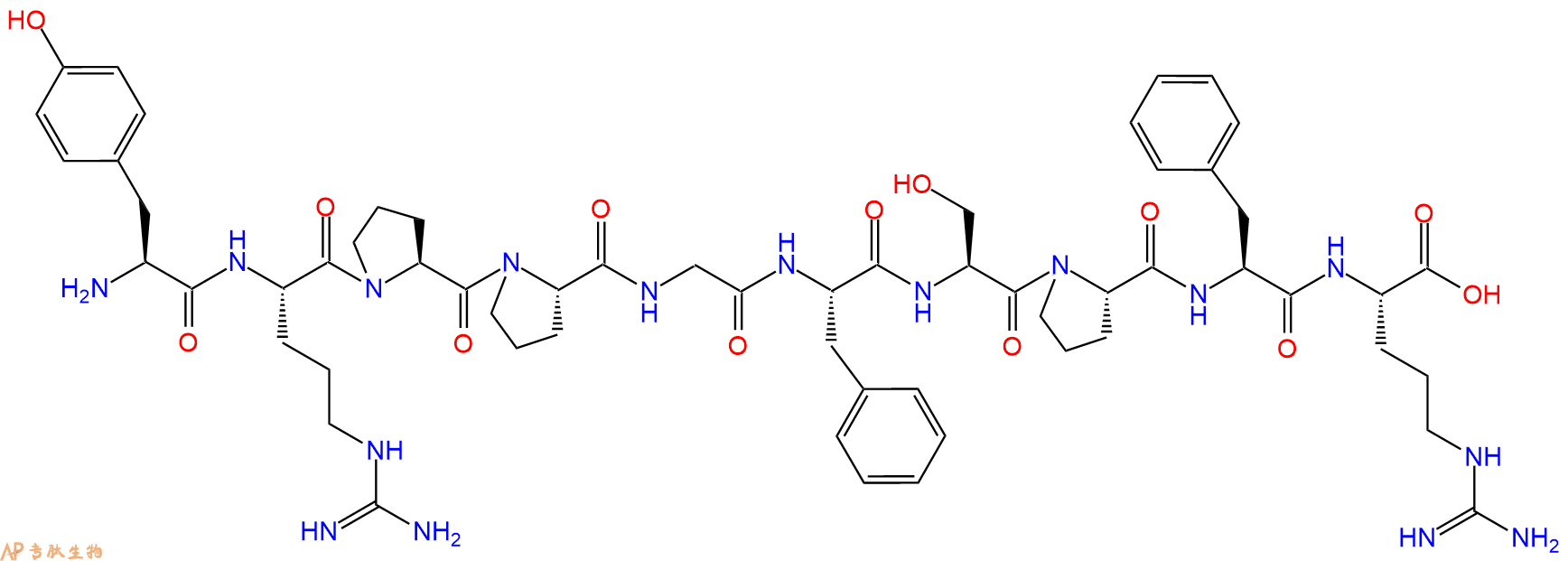
多肽H2N-Tyr-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg-COOH的合成步骤:
1、合成CTC树脂:称取2.91g CTC Resin(如初始取代度约为1.12mmol/g)和3.91mmol Fmoc-Arg(Pbf)-OH于反应器中,加入适量DCM溶解氨基酸(需要注意,此时CTC树脂体积会增大好几倍,避免DCM溶液过少),再加入9.78mmol DIPEA(Mw:129.1,d:0.740g/ml),反应2-3小时后,可不抽滤溶液,直接加入1ml的HPLC级甲醇,封端半小时。依次用DMF洗涤2次,甲醇洗涤1次,DCM洗涤一次,甲醇洗涤一次,DCM洗涤一次,DMF洗涤2次(这里使用甲醇和DCM交替洗涤,是为了更好地去除其他溶质,有利于后续反应)。得到 Fmoc-Arg(Pbf)-CTC Resin。结构图如下:
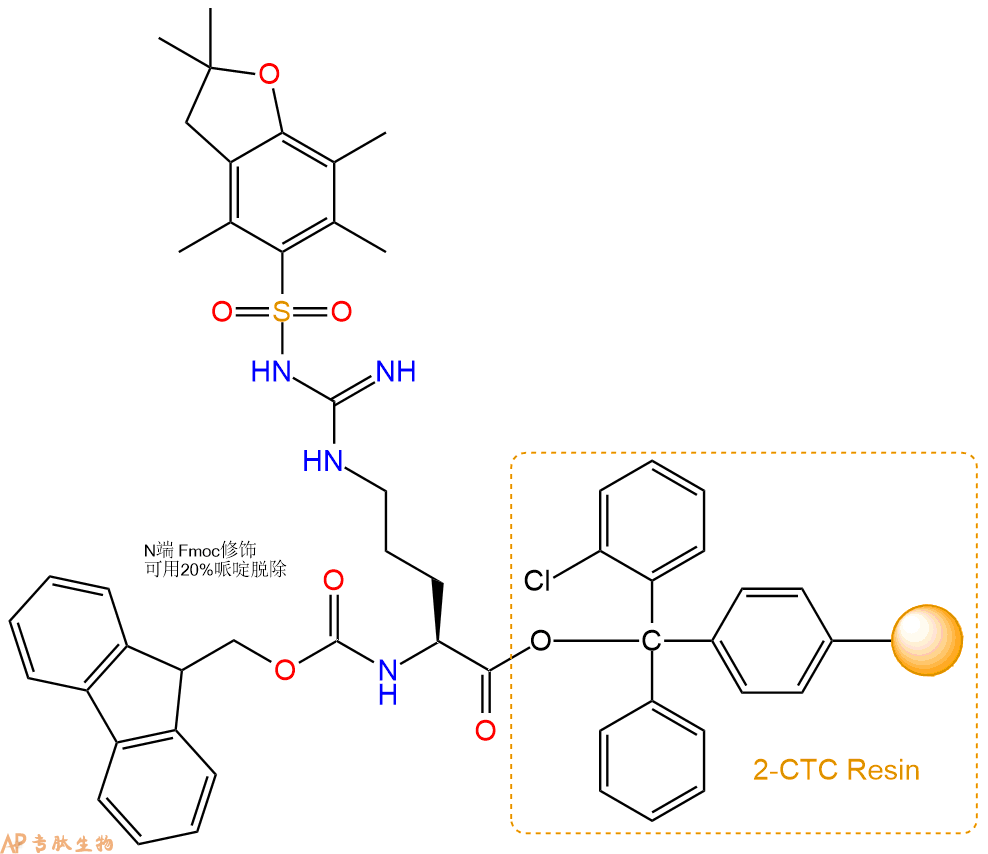
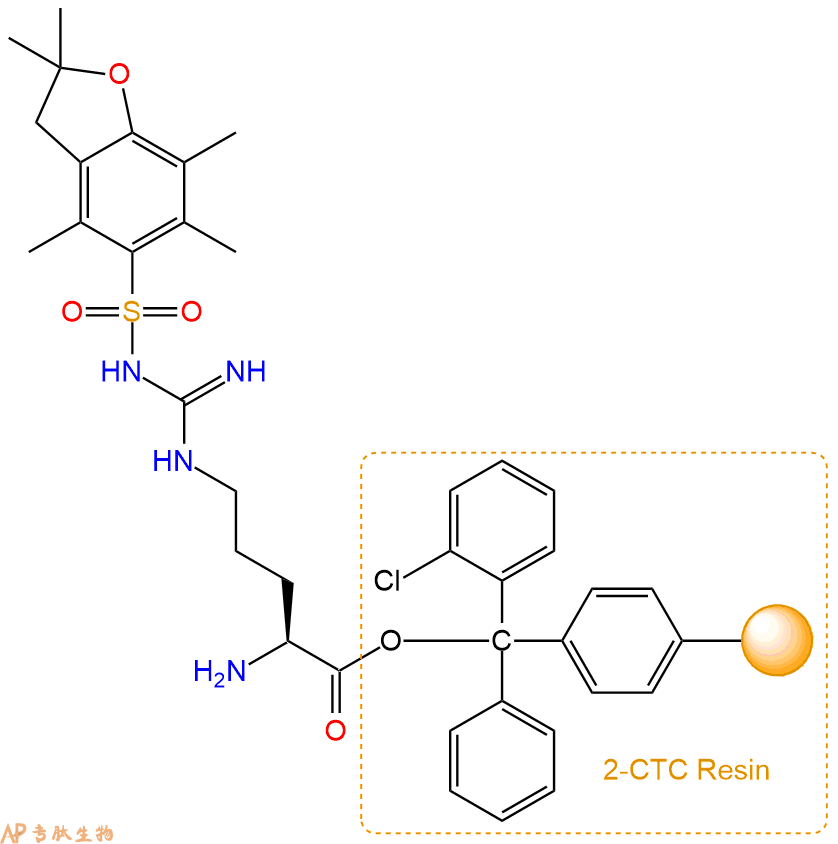
2、脱Fmoc:加3倍树脂体积的20%Pip/DMF溶液,鼓氮气30分钟,然后2倍树脂体积的DMF 洗涤5次。得到 H2N-Arg(Pbf)-CTC Resin 。(此步骤脱除Fmoc基团,茚三酮检测为蓝色,Pip为哌啶)。结构图如下:
3、缩合:取9.78mmol Fmoc-Phe-OH 氨基酸,加入到上述树脂里,加适当DMF溶解氨基酸,再依次加入19.56mmol DIPEA,9.29mmol HBTU。反应30分钟后,取小样洗涤,茚三酮检测为无色。用2倍树脂体积的DMF 洗涤3次树脂。(洗涤树脂,去掉残留溶剂,为下一步反应做准备)。得到Fmoc-Phe-Arg(Pbf)-CTC Resin。氨基酸:DIPEA:HBTU:树脂=3:6:2.85:1(摩尔比)。结构图如下:
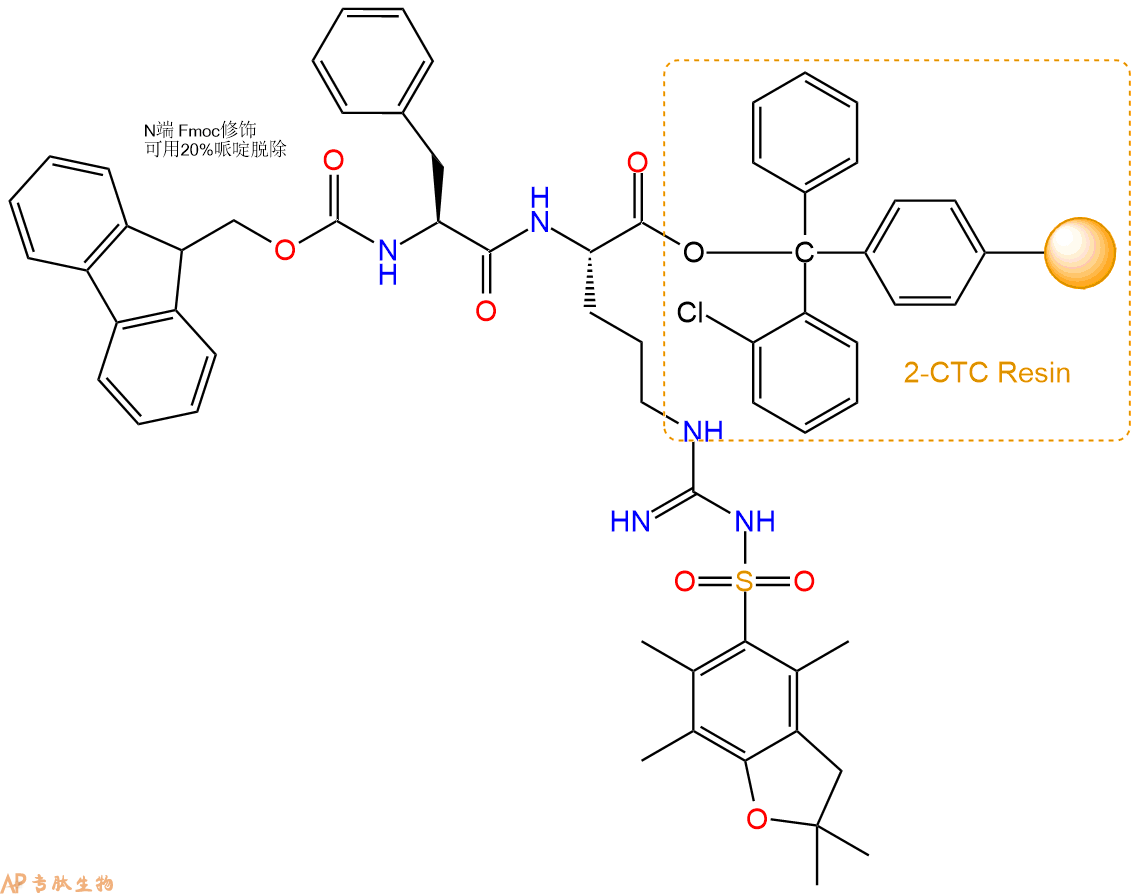
4、依次循环步骤二、步骤三,依次得到
H2N-Phe-Arg(Pbf)-CTC Resin
Fmoc-Pro-Phe-Arg(Pbf)-CTC Resin
H2N-Pro-Phe-Arg(Pbf)-CTC Resin
Fmoc-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
H2N-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
Fmoc-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
H2N-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
Fmoc-Gly-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
H2N-Gly-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
Fmoc-Pro-Gly-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
H2N-Pro-Gly-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
Fmoc-Pro-Pro-Gly-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
H2N-Pro-Pro-Gly-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
Fmoc-Arg(Pbf)-Pro-Pro-Gly-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
H2N-Arg(Pbf)-Pro-Pro-Gly-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
Fmoc-Tyr(tBu)-Arg(Pbf)-Pro-Pro-Gly-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin
以上中间结构,均可在专肽生物多肽计算器-多肽结构计算器中,一键画出。
最后再经过步骤二得到 H2N-Tyr(tBu)-Arg(Pbf)-Pro-Pro-Gly-Phe-Ser(tBu)-Pro-Phe-Arg(Pbf)-CTC Resin,结构如下:

5、切割:6倍树脂体积的切割液(或每1g树脂加8ml左右的切割液),摇床摇晃 2小时,过滤掉树脂,用冰无水乙醚沉淀滤液,并用冰无水乙醚洗涤沉淀物3次,最后将沉淀物放真空干燥釜中,常温干燥24小试,得到粗品H2N-Tyr-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg-COOH。结构图见产品结构图。
切割液选择:1)TFA:H2O=95%:5%、TFA:H2O=97.5%:2.5%
2)TFA:H2O:TIS=95%:2.5%:2.5%
3)三氟乙酸:茴香硫醚:1,2-乙二硫醇:苯酚:水=87.5%:5%:2.5%:2.5%:2.5%
(前两种适合没有容易氧化的氨基酸,例如Trp、Cys、Met。第三种适合几乎所有的序列。)
6、纯化冻干:使用液相色谱纯化,收集目标峰液体,进行冻干,获得蓬松的粉末状固体多肽。不过这时要取小样复测下纯度 是否目标纯度。
7、最后总结:
杭州专肽生物技术有限公司(ALLPEPTIDE https://www.allpeptide.com)主营定制多肽合成业务,提供各类长肽,短肽,环肽,提供各类修饰肽,如:荧光标记修饰(CY3、CY5、CY5.5、CY7、FAM、FITC、Rhodamine B、TAMRA等),功能基团修饰肽(叠氮、炔基、DBCO、DOTA、NOTA等),同位素标记肽(N15、C13),订书肽(Stapled Peptide),脂肪酸修饰肽(Pal、Myr、Ste),磷酸化修饰肽(P-Ser、P-Thr、P-Tyr),环肽(酰胺键环肽、一对或者多对二硫键环),生物素标记肽,PEG修饰肽,甲基化修饰肽
以上所有内容,为专肽生物原创内容,请勿发布到其他网站上。





