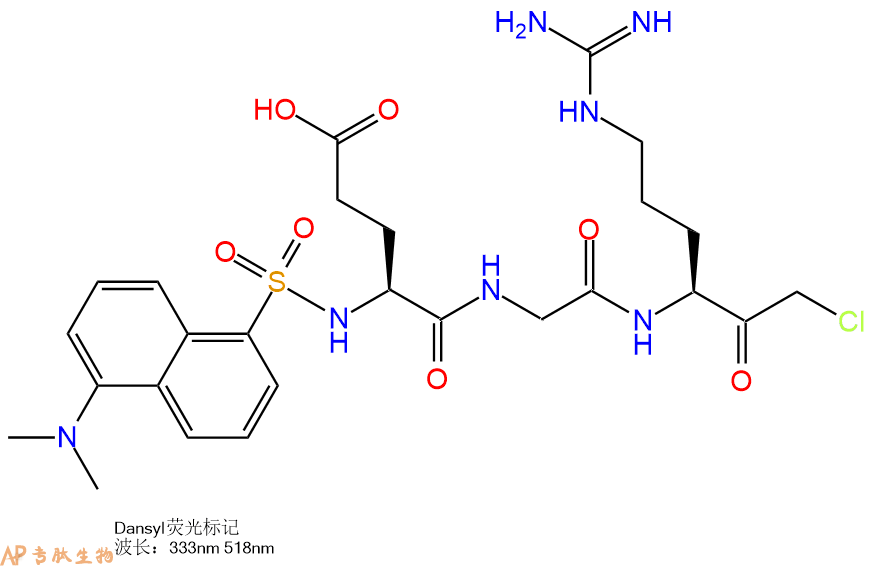
纤溶酶原激活物,因子Xa和尿激酶的不可逆抑制剂。 Dns-EGR-CMK可以直接监控标记酶的相互作用。
编号:182884
CAS号:69024-84-6
单字母:Dansyl-EGR-CMK
| 编号: | 182884 |
| 中文名称: | Dansyl修饰肽:Dansyl-Glu-Gly-Arg-CMK |
| 英文名: | Dansyl-Glu-Gly-Arg-CMK |
| CAS号: | 69024-84-6 |
| 单字母: | Dansyl-EGR-CMK |
| 三字母: | Dansyl N端Dansyl标记 -Glu谷氨酸 -Gly甘氨酸 -Arg精氨酸 -CMKC端氯甲基酮修饰 |
| 氨基酸个数: | 3 |
| 分子式: | C26H36N6O8S1l1 |
| 平均分子量: | 592.66 |
| 精确分子量: | 592.23 |
| 等电点(PI): | 8.3 |
| pH=7.0时的净电荷数: | - |
| 平均亲水性: | 3 |
| 疏水性值: | -2.8 |
| 外观与性状: | 白色粉末状固体 |
| 消光系数: | - |
| 来源: | 人工化学合成,仅限科学研究使用,不得用于人体。 |
| 纯度: | 95%、98% |
| 盐体系: | 可选TFA、HAc、HCl或其它 |
| 储存条件: | 负80℃至负20℃ |
| 标签: | 荧光共振能量转移肽(FRET) CMK(氯甲基酮)修饰 抑制剂相关肽(Inhibitor Peptide) Dansyl标记肽 三肽 |
Irreversible inhibitor of plasminogen activator, Factor Xa and urokinase. Dns-EGR-CMK allows direct monitoring of interactions of labeled enzyme.
荧光标记所依赖的化合物称为荧光物质。荧光物质是指具有共轭双键体系化学结构的化合物,受到紫外光或蓝紫光照射时,可激发成为激发态,当从激发态恢复基态时,发出荧光。荧光标记技术指利用荧光物质共价结合或物理吸附在所要研究分子的某个基团上,利用它的荧光特性来提供被研究对象的信息。荧光标记的无放射物污染,操作简便等优点,使得荧光标记物在许多研究领域的应用日趋广泛。人们利用利用荧光标记的多肽来检测目标蛋白的活性,并将其发展的高通量活性筛选方法应用于疾病治疗靶点蛋白的药物筛选和药物开发(例如,各种激酶、磷酸酶、肽酶等)。专肽生物经过长期开发,能够提供技术成熟的各种荧光标记多肽。
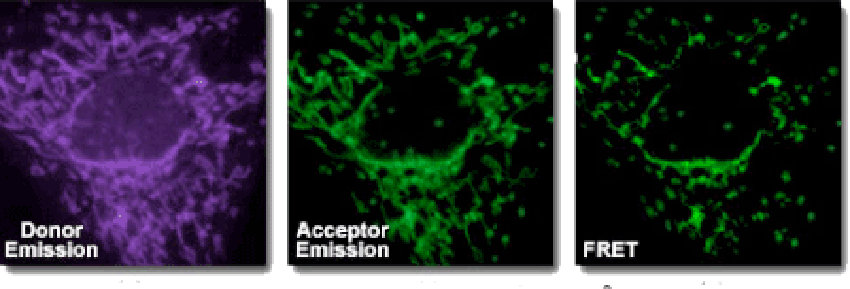
荧光共振能量转移(FRET)是一种非辐射能量跃迁,通过分子间的电偶极相互作用,将供体激发态能量转移到受体激发态的过程。此过程没有光子的参与,所以是非辐射的。该分析方法具有快速、敏感和简单等优点。
用于FRET试验的染料是可以相同的。但在大多数应用中其实是使用不同的染料。例如,一个供体基团(EDANS)和接受基因(DABCYL)匀被连接到一HIV蛋白酶的天然底物上,当该底物未被切断时,DABCYL可淬灭EDANS,从而检测不到荧光。当该底物被HIV-1蛋白酶切断后,EDANS不再被DABCYL淬灭,随即可检测到EDANS荧光。蛋白酶抑制剂的有效性可凭借EDANS荧光强度的变化进行监测。
FRET肽是研究肽酶特异性的便利工具,由于其反应过程可被连续监测,为酶活性的检测提供了一个便捷的方法。供体/受体对的肽键水解后产生的荧光可衡量纳摩尔级浓度的酶活性。当FRET肽是完整的,表现出的是内部的荧光猝灭,但当供体/受体对的任何肽键断裂就会释放出荧光,此荧光可被连续检测,从而可对酶的活性进行定量分析。FRET 肽可作为各类酶研究的合适底物,比如:肽酶、蛋白酶、激酶、磷酸酶的动力特征和功能特征;对新的蛋白水解酶的筛选和检测;对多肽折叠的构象研究等。
1、常用FRET的标准染料组合。
| 常用FRET的标准染料组合 |
| FAM/Lys(Dabcyl) |
| FAM/TAMRA |
| MCA/Lys(Dnp) |
| Abz/Tyr (NO2) |
| Abz/Dnp |
| Abz/EDDnp |
| Dabcyl/Glu(EDANS) |
| Dansyl//Glu(EDANS) |
2、FRET共振能量转移引发荧光猝灭的激发与发射波
| 猝灭剂 | 荧光团 | 激发波(nm) | 发射波(nm) |
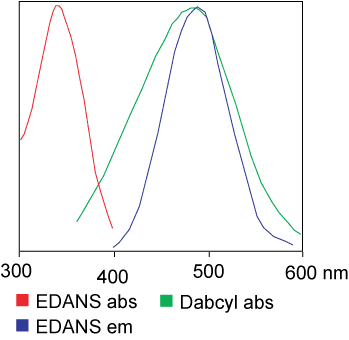
| Dabcyl | Edans | 336 | 490 |
| Dansyl | Trp | 336 | 350 |
| DNP | Trp | 328 | 350 |
| DNP | MCA | 328 | 393 |
| DNP | Abz | 328 | 420 |
| Tyr (NO2) | Abz | 320 | 420 |
3、常规RET供体(Donor)-接受(Aceptor)对的福斯特临界距离(Forster Critical Distance)
| 供体 | 受体 | 福斯特临界距离(nm) |
| Cy5 | Cy5.5 | >8.0 |
| B-Phycoerythrin | Cy5.5 | 7.2 |
| FITC | Eosin Thiosemicarbazide | 6.1-6.4 |
| Rhodamine 6G | Malachite Green | 6.1-6.4 |
| BODIPY FL (1) | BODIPY FL (1) | 5.7 |
| GFP | YFP | 5.5-5.7 |
| Cy3 | Cy5.5 | 5 |
| Fluorescein | Tetramethylrhodamine | 4.9-5.5 |
| CF (2) | Texas Red | 5.1 |
| CFP | GFP | 4.7-4.9 |
| Dansyl | Octadecylrhodamine | 4.3 |
| Dansyl | FITC | 3.3-4.1 |
| BFP | DsRFP | 3.1-3.3 |
| IAEDANS (4) | DDPM (3) | 2.5-2.9 |
| Tryptophan | Dansyl | 2.1 |
| (1): 4,4-difluoro-4-bora-3a, 4a-diaza-s-indacene | ||
| (2): carboxyfluorescein succinimidyl ester | ||
| (3): N-(4-dimethylamino-3,5-dinitrophenyl) maleimide | ||
| (4): 5-(2-iodoacetylaminoethyl)aminonaphthalene-1-sulfonic acid | ||
对于分子生物学来讲,生物分析手段的发展,是阐明机理的必要条件。在研究分子间相互作用的道路上,人们不断探索,总结出很多方法,免疫技术,晶体衍射,核磁共振等。1948年,荧光共振能量转移(Fluorescence resonance energy transfer,FRET)理论被首次提出,它可以测定1.0-6.0nm距离内分子间的相互作用。1967年,这一理论得到了实验验证,将1.0-6.0nm的距离称为光学尺。二十世纪八十年代出,通过科学家的不断探索,Fret技术成功运用到蛋白质结构的研究中。自Fret荧光共振能量技术诞生以来,已结合多种先进的技术和方法,如电子显微镜,X射线衍射等,推动了分子生物学检测手段的发展。
荧光共振能量转移技术,是采用物理方法去检测分子间的相互作用的方法。他适用于在细胞正常的生理条件下,验证已知分子间是否存在相互作用。此方法的检测原理如下;
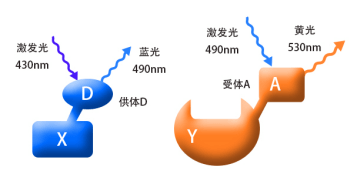
将我们要检测的蛋白(如图X和Y),分别偶联上D和A荧光蛋白,D和A是一对荧光物质,我们称之为供体(donor)和受体(acceptor)。当用430nm的紫光去激发X融合蛋白时,它能够产生490nm的蓝色荧光;同样,当我们用490nm的蓝光去激发Y融合蛋白时,它能够产生530nm的黄色荧光。(结合图1) 。
当蛋白X和Y间没有相互作用时(两者的空间距离>10nm),融合蛋白X和Y分别产生相应的荧光而被检测到,
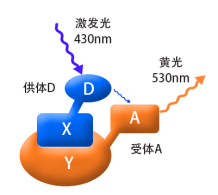
如果蛋白X和Y间存在相互作用(两者的空间距离需<10nm,结合图2),用紫光激发融合蛋白X其产生的蓝光会被融合蛋白Y吸收,从而产生黄色荧光,这时,在细胞内将检测不到蓝色荧光的存在。这时因为能量从X融合蛋白转移到了Y融合蛋白,这就是荧光共振能量转移技术。
一个理想的Fret相互作用体系,要求要有一对合适的荧光物质, 即供体的发射光谱与受体的吸收光谱有明显的重叠。且当供体的激发波长时对受体无影响,供体和受体的发射光谱要完全分开,否则容易造成光谱干涉,而使反应体系不稳定。目前,较为常用的供体-受体分子对,主要有绿色荧光蛋白类(GFPs)和染料类。绿色荧光蛋白类有CFP-YFP,BFP-GFP,BFP-YFP等,染料类的有Cy3-Cy5,FITC-Rhodamine等。且这些荧光物质要能够标记在研究对象上。
| 优点 | 缺点 |
| 在活细胞的正常生理条件下进行检测,观察大分子在细胞内的构象变化与相互作用,并弥补了需破碎细胞检测相互作用的缺点 | 应用比较局限,一般需要在待检测分子上偶联荧光物质(加上标记) |
| 灵敏度高,可实现对单细胞水平的研究,研究单个受体分子 | 对实验要求较高,如供受体的光谱重叠不好,会导致荧光干扰,对供受体的抗干扰能力,水溶性等要求高 |
| 可与多种仪器和技术结合使用,如显微镜,色谱技术,电泳,流失细胞技术等 | 需要不断探索合适的供体和受体,且能够标记分子 难以观察瞬时的分子间作用,检测要求大量的样品 |
以荧光物质CFP(供体)-YFP(受体)为例,检测AB蛋白在细胞内的相互作用。
最常见的一对标记组合是 Dancyl和Edans,
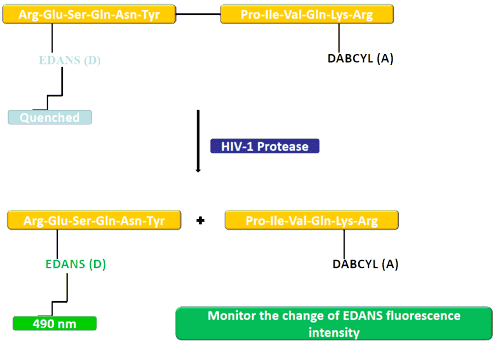
在本例中,荧光团 (EDANS) 和猝灭剂 (DABCYL) 与 HIV 蛋白酶的天然底物相连。在未裂解的底物中,DABCYL 淬灭 EDANS,因此没有可检测到的荧光。底物被 HIV-1 蛋白酶切割后,DABCYL 不再淬灭 EDANS,从而检测到 EDANS 荧光。然后可以监测 EDANS 荧光强度的变化以评估蛋白酶抑制剂的效率。
FRET 肽可用于研究肽酶特异性,因为它们可以连续监测反应,从而快速确定酶活性。供体/受体对之间的肽键可以被切割,从而产生荧光信号以测量纳摩尔浓度的酶活性。当未被切割时,FRET 肽会淬灭内部荧光;然而,供体/受体对之间肽键的断裂会释放出可以连续检测到的荧光信号,从而可以量化酶的活性。
FRET 肽在许多不同的酶研究中用作合适的底物:
肽酶、蛋白酶、激酶和磷酸酶的动力学和功能表征。
筛选和检测新型蛋白水解酶。
肽折叠的构象研究。
定义
酶是用于生化反应的非常有效的催化剂。它们通过提供较低活化能的替代反应途径来加快反应速度。酶作用于底物并产生产物。一些物质降低或什至停止酶的催化活性被称为抑制剂。
发现
1965年,Umezawa H分析了微生物产生的酶抑制剂,并分离出了抑制亮肽素和抗痛药的胰蛋白酶和木瓜蛋白酶,乳糜蛋白酶抑制的胰凝乳蛋白酶,胃蛋白酶抑制素抑制胃蛋白酶,泛磷酰胺抑制唾液酸酶,乌藤酮抑制酪氨酸羟化酶,多巴汀抑制多巴胺3-羟硫基嘧啶和多巴胺3-羟色胺酶酪氨酸羟化酶和多巴胺J3-羟化酶。最近,一种替代方法已应用于预测新的抑制剂:合理的药物设计使用酶活性位点的三维结构来预测哪些分子可能是抑制剂1。已经开发了用于识别酶抑制剂的基于计算机的方法,例如分子力学和分子对接。
结构特征
已经确定了许多抑制剂的晶体结构。已经确定了三种与凝血酶复合的高效且选择性的低分子量刚性肽醛醛抑制剂的晶体结构。这三种抑制剂全部在P3位置具有一个新的内酰胺部分,而对胰蛋白酶选择性最高的两种抑制剂在P1位置具有一个与S1特异性位点结合的胍基哌啶基。凝血酶的抑制动力学从慢到快变化,而对于胰蛋白酶,抑制的动力学在所有情况下都快。根据两步机理2中稳定过渡态络合物的缓慢形成来检验动力学。
埃米尔•菲舍尔(Emil Fischer)在1894年提出,酶和底物都具有特定的互补几何形状,彼此恰好契合。这称为“锁和钥匙”模型3。丹尼尔·科什兰(Daniel Koshland)提出了诱导拟合模型,其中底物和酶是相当灵活的结构,当底物与酶4相互作用时,活性位点通过与底物的相互作用不断重塑。
在众多生物活性肽的成熟过程中,需要由其谷氨酰胺(或谷氨酰胺)前体形成N末端焦谷氨酸(pGlu)。游离形式并与底物和三种咪唑衍生抑制剂结合的人QC的结构揭示了类似于两个锌外肽酶的α/β支架,但有多个插入和缺失,特别是在活性位点区域。几种活性位点突变酶的结构分析为针对QC相关疾病5的抑制剂的合理设计提供了结构基础。
作用方式
酶是催化化学反应的蛋白质。酶与底物相互作用并将其转化为产物。抑制剂的结合可以阻止底物进入酶的活性位点和/或阻止酶催化其反应。抑制剂的种类繁多,包括:非特异性,不可逆,可逆-竞争性和非竞争性。可逆抑制剂 以非共价相互作用(例如疏水相互作用,氢键和离子键)与酶结合。非特异性抑制方法包括最终使酶的蛋白质部分变性并因此不可逆的任何物理或化学变化。特定抑制剂 对单一酶发挥作用。大多数毒药通过特异性抑制酶发挥作用。竞争性抑制剂是任何与底物的化学结构和分子几何结构非常相似的化合物。抑制剂可以在活性位点与酶相互作用,但是没有反应发生。非竞争性抑制剂是与酶相互作用但通常不在活性位点相互作用的物质。非竞争性抑制剂的净作用是改变酶的形状,从而改变活性位点,从而使底物不再能与酶相互作用而产生反应。非竞争性抑制剂通常是可逆的。不可逆抑制剂与酶形成牢固的共价键。这些抑制剂可以在活性位点附近或附近起作用。
功能
工业应用中, 酶在商业上被广泛使用,例如在洗涤剂,食品和酿造工业中。蛋白酶用于“生物”洗衣粉中,以加速蛋白质在诸如血液和鸡蛋等污渍中的分解。商业上使用酶的问题包括:它们是水溶性的,这使得它们难以回收,并且一些产物可以抑制酶的活性(反馈抑制)。
药物分子,许多药物分子都是酶抑制剂,药用酶抑制剂通常以其特异性和效力为特征。高度的特异性和效力表明该药物具有较少的副作用和较低的毒性。酶抑制剂在自然界中发现,并且也作为药理学和生物化学的一部分进行设计和生产6。
天然毒物 通常是酶抑制剂,已进化为保护植物或动物免受天敌的侵害。这些天然毒素包括一些已知最剧毒的化合物。
神经气体( 例如二异丙基氟磷酸酯(DFP))通过与丝氨酸的羟基反应生成酯,从而抑制了乙酰胆碱酯酶的活性位点。
参考
1、Scapin G (2006). Structural biology and drug discovery. Curr. Pharm. Des., 12(17):2087–2097.
2、Krishnan R, Zhang E, Hakansson K, Arni RK, Tulinsky A, Lim-Wilby MS, Levy OE, Semple JE, Brunck TK (1998). Highly selective mechanism-based thrombin inhibitors: structures of thrombin and trypsin inhibited with rigid peptidyl aldehydes. Biochemistry, 37 (35):12094-12103.
3、Fischer E (1894). Einfluss der configuration auf die wirkung der enzyme. Ber. Dt. Chem. Ges., 27:2985–2993.
4、Koshland DE (1958). Application of a theory of enzyme specificity to protein synthesis. PNAS., 44 (2):98–104.
5、Huang KF, Liu YL, Cheng WJ, Ko TP, Wang AH (2005). Crystal structures of human glutaminyl cyclase, an enzyme responsible for protein N-terminal pyroglutamate formation. PNAS., 102(37):13117-13122.
6、Holmes CF, Maynes JT, Perreault KR, Dawson JF, James MN (2002). Molecular enzymology underlying regulation of protein phosphatase-1 by natural toxins. Curr Med Chem., 9(22):1981-1989.
Definition
Enzymes are very efficient catalysts for biochemical reactions. They speed up reactions by providing an alternative reaction pathway of lower activation energy. Enzyme acts on substrate and gives rise to a product. Some substances reduce or even stop the catalytic activities of enzymes are called inhibitors.
Discovery
In 1965, Umezawa H analysed enzyme inhibitors produced by microorganisms and isolated leupeptin and antipain inhibiting trypsin and papain, chymostatin inhibiting chymotrypsin, pepstatin inhibiting pepsin, panosialin inhibiting sialidases, oudenone inhibiting tyrosine hydroxylase, dopastin inhibiting dopamine 3-hydroxylase, aquayamycin and chrothiomycin inhibiting tyrosine hydroxylase and dopamine J3-hydroxylase . Recently, an alternative approach has been applied to predict new inhibitors: rational drug design uses the three-dimensional structure of an enzyme's active site to predict which molecules might be inhibitors 1. Computer-based methods for identifying inhibitor for an enzyme have been developed, such as molecular mechanics and molecular docking.
Structural Characteristics
The crystal structures of many inhibitors have been determined. The crystal structures of three highly potent and selective low-molecular weight rigid peptidyl aldehyde inhibitors complexed with thrombin have been determined. All the three inhibitors have a novel lactam moiety at the P3 position, while the two with greatest trypsin selectivity have a guanidinopiperidyl group at the P1 position that binds in the S1 specificity site. The kinetics of inhibition vary from slow to fast with thrombin and are fast in all cases with trypsin. The kinetics are examined in terms of the slow formation of a stable transition-state complex in a two-step mechanism 2.
Emil Fischer in 1894 suggested that both the enzyme and the substrate possess specific complementary geometric shapes that fit exactly into one another.This is known as "the lock and key" model 3. Daniel Koshland suggested induced fit model where substrate and enzymes are rather flexible structures, the active site is continually reshaped by interactions with the substrate as the substrate interacts with the enzyme 4.
N-terminal pyroglutamate (pGlu) formation from its glutaminyl (or glutamyl) precursor is required in the maturation of numerous bioactive peptides. The structure of human QC in free form and bound to a substrate and three imidazole-derived inhibitors reveals an alpha/beta scaffold akin to that of two-zinc exopeptidases but with several insertions and deletions, particularly in the active-site region. The structural analyses of several active-site-mutant enzymes provide a structural basis for the rational design of inhibitors against QC-associated disorders 5.
Mode of Action
Enzymes are proteins that catalyze chemical reactions. Enzymes interact with substrate and convert them into products. Inhibitor binding can stop a substrate from entering the enzyme's active site and/or hinder the enzyme from catalyzing its reaction. There are a variety of types of inhibitors including: nonspecific, irreversible, reversible - competitive and noncompetitive. Reversible inhibitors bind to enzymes with non-covalent interactions like hydrophobic interactions, hydrogen bonds, and ionic bonds. Non-specific methods of inhibition include any physical or chemical changes which ultimately denature the protein portion of the enzyme and are therefore irreversible. Specific Inhibitors exert their effects upon a single enzyme. Most poisons work by specific inhibition of enzymes. A competitive inhibitor is any compound which closely resembles the chemical structure and molecular geometry of the substrate. The inhibitor may interact with the enzyme at the active site, but no reaction takes place. A noncompetitive inhibitor is a substance that interacts with the enzyme, but usually not at the active site. The net effect of a non competitive inhibitor is to change the shape of the enzyme and thus the active site, so that the substrate can no longer interact with the enzyme to give a reaction. Non competitive inhibitors are usually reversible. Irreversible Inhibitors form strong covalent bonds with an enzyme. These inhibitors may act at, near, or remote from the active site .
Functions
Industrial application, enzymes are widely used commercially, for example in the detergent, food and brewing industries. Protease enzymes are used in 'biological' washing powders to speed up the breakdown of proteins in stains like blood and egg. Problems using enzymes commercially include: they are water soluble which makes them hard to recover and some products can inhibit the enzyme activity (feedback inhibition) .
Drug molecules, many drug molecules are enzyme inhibitors and a medicinal enzyme inhibitor is usually characterized by its specificity and its potency. A high specificity and potency suggests that a drug will have fewer side effects and less toxic. Enzyme inhibitors are found in nature and are also designed and produced as part of pharmacology and biochemistry 6.
Natural poisons are often enzyme inhibitors that have evolved to defend a plant or animal against predators. These natural toxins include some of the most poisonous compounds known.
Nerve gases such as diisopropylfluorophosphate (DFP) inhibit the active site of acetylcholine esterase by reacting with the hydroxyl group of serine to make an ester.
References
Scapin G (2006). Structural biology and drug discovery. Curr. Pharm. Des., 12(17):2087–2097.
Krishnan R, Zhang E, Hakansson K, Arni RK, Tulinsky A, Lim-Wilby MS, Levy OE, Semple JE, Brunck TK (1998). Highly selective mechanism-based thrombin inhibitors: structures of thrombin and trypsin inhibited with rigid peptidyl aldehydes. Biochemistry, 37 (35):12094-12103.
Fischer E (1894). Einfluss der configuration auf die wirkung der enzyme. Ber. Dt. Chem. Ges., 27:2985–2993.
Koshland DE (1958). Application of a theory of enzyme specificity to protein synthesis. PNAS., 44 (2):98–104.
Huang KF, Liu YL, Cheng WJ, Ko TP, Wang AH (2005). Crystal structures of human glutaminyl cyclase, an enzyme responsible for protein N-terminal pyroglutamate formation. PNAS., 102(37):13117-13122.
Holmes CF, Maynes JT, Perreault KR, Dawson JF, James MN (2002). Molecular enzymology underlying regulation of protein phosphatase-1 by natural toxins. Curr Med Chem., 9(22):1981-1989.
多肽荧光标记由于没有放射性,实验操作简单。因此,目前在生物学研究中多肽荧光标记应用非常广泛,多肽荧光标记方法与荧光试剂的结构有关系,对于有游离羧基的采用的方法与接多肽反应相同,也采用HBTU/HOBt/DIEA方法连接。 在N端标记FITC的多肽需经历环化作用来形成荧光素,通常会伴有最后一个氨基酸的去除,但当有一个间隔器如氨基己酸,或者是通过非酸性环境将目的多肽从树脂上切下来时,这种情况可避免在切割的过程中被TFA切割掉。
人们利用利用荧光标记的多肽来检测目标蛋白的活性,并将 其发展的高通量活性筛选方法应用于疾病治疗靶点蛋白的药物筛选和药物开发(例如,各种激 酶、磷酸酶、肽酶等)。
专肽生物能够提供技术成熟的各种荧光标记多肽。
下面是一些常见的多肽修饰荧光物质结构:
FITC标记
FITC(异硫氰酸荧光素)具有比较高的活性,我们公司可以通过两种方式将FITC标记于多肽 上:(1) 将FITC标记于赖氨酸(Lys)或被选择性地脱保护的鸟氨酸(ornithine)侧链氨基 上;(2) 将FITC标记于多肽N端氨基。
当在N端标记时,建议在最后一个氨基和由异硫氰酸酯与氨基反应产生的硫脲键之间引入 烷基间隔器(alkyl spacer),如氨基己酸(Ahx)。链接切割需要酸性环境,在N端标记FITC 的多肽需经历环化作用来形成荧光素,通常会伴有最后一个氨基酸的去除,但当有一个间隔器 如氨基己酸,或者是通过非酸性环境将目的肽从树脂上切下来时,这种情况可避免。空间位阻 被认为是在荧光染料前使用Ahx的主要原因,而不是为什么FITC不能直接偶联在多肽上的原因。
Ahx或b-Ala均可作为间隔器用于FITC标记的多肽上。

| 荧光修饰中文名称 | N端 | N端带有linker |
| 生物素标记多肽 | Biotin- | Biotin-Ahx- |
| 异硫氰酸荧光素 | FITC- | FITC-Ahx- |
| 5-羧基荧光素 | 5-FAM- | 5-FAM-Ahx- |
| 丹磺酰荧光素 | Dansyl- | Dansyl-Ahx- |
| 5-羧基四甲基罗丹明 | TMR- (TAMRA-) | TMR-Ahx- (TAMRA-Ahx-) |
| 多肽N端 | 多肽序列中间 | N端带有linker |
| 生物素标记多肽 | Biotin- | 多肽C端 |
| Lys(Biotin)- | -Lys(Biotin)-- | -Lys(Biotin) |
| Lys(FITC)- | -Lys(FITC)- | -Lys(FITC) |
| Lys(5-FAM)- | -Lys(5-FAM)- | -Lys(5-FAM) |
| Lys(Dansyl)- | -Lys(Dansyl)- | -Lys(Dansyl) |
| Lys(TMR)- | -Lys(TMR)- | -Lys(TMR) |
| Lys(Dnp)- | -Lys(Dnp)- | -Lys(Dnp) |
专肽常做的荧光物质的激发光波长和发射光波长。可供参考选择:
| 荧光基团 | Ex(nm) | Em(nm) | 荧光基团 | Ex(nm) | Em(nm) |
| 羟基香豆素 | 325 | 386 | R-phycoerythrin (PE) (489) | 565 | 578 |
| 丹磺酰氯 | 340 | 578 | Rhodamine Red-X | 560 | 580 |
| AMC | 345 | 445 | Tamara | 565 | 580 |
| 甲氧基香豆素 | 360 | 410 | Alexa fluor 555 | 556 | 573 |
| Alexa fluor 系列 | 345 | 442 | Alexa fluor 546 | 556 | 573 |
| 氨基香豆素 | 350 | 445 | Rox | 575 | 602 |
| Dabcyl | 453 | - | Alexa fluor 568 | 578 | 603 |
| Cy2 | 490 | 510 | Texas Red | 589 | 615 |
| FAM | 495 | 517 | Alexa fluor 594 | 590 | 617 |
| Alexa fluor 488 | 494 | 517 | Alexa fluor | 621 | 639 |
| FITC | 495 | 519 | Alexa fluor 633 | 650 | 668 |
| Alexa fluor 430 | 430 | 545 | Cy5 (625) | 650 | 670 |
| 5-FAM | 492 | 518 | Alexa fluor 660 | 663 | 690 |
| Alexa fluor 532 | 530 | 530 | Cy5.5 | 675 | 694 |
| HEX | 535 | 556 | TruRed | 490; 675 | 695 |
| 5-TAMRA | 542 | 568 | Alexa fluor 680 | 679 | 702 |
| Cy3 | 550 | 570 | Cy7 | 743 | 767 |
| TRITC | 547 | 572 | Cy3.5 | 581 | 596 |
| DOI | 名称 | |
|---|---|---|
| 10.1016/j.jmb.2005.04.052 | Na+ site in blood coagulation factor IXa: effect on catalysis and factor VIIIa binding | 下载 |
| 10.1016/0049-3848(92)90170-f | A chromogenic enzymatic assay capable of detecting prourokinase-like material in plasma | 下载 |
| 10.1074/jbc.M606441200 | Effects of factor Xa and protein S on the individual activated protein C-mediated cleavages of coagulation factor Va | 下载 |
| 10.1073/pnas.89.1.152 | Antibody-probed conformational transitions in the protease domain of human factor IX upon calcium binding and zymogen activation: putative high-affinity Ca(2+)-binding site in the protease domain | 下载 |
| 10.1074/jbc.M707234200 | Characterization of Novel Forms of Coagulation Factor XIa: independence of factor XIa subunits in factor IX activation | 下载 |
| 10.1016/s0076-6879(81)80065-1 | Inactivation of trypsin-like enzymes with peptides of arginine chloromethyl ketone | 下载 |
| 10.1093/emboj/16.16.4797 | Lysine 156 promotes the anomalous proenzyme activity of tPA: X-ray crystal structure of single-chain human tPA | 下载 |





