华南理工大学林章凛课题组开发基于Spy化学的蛋白(酶)定向固定化方法
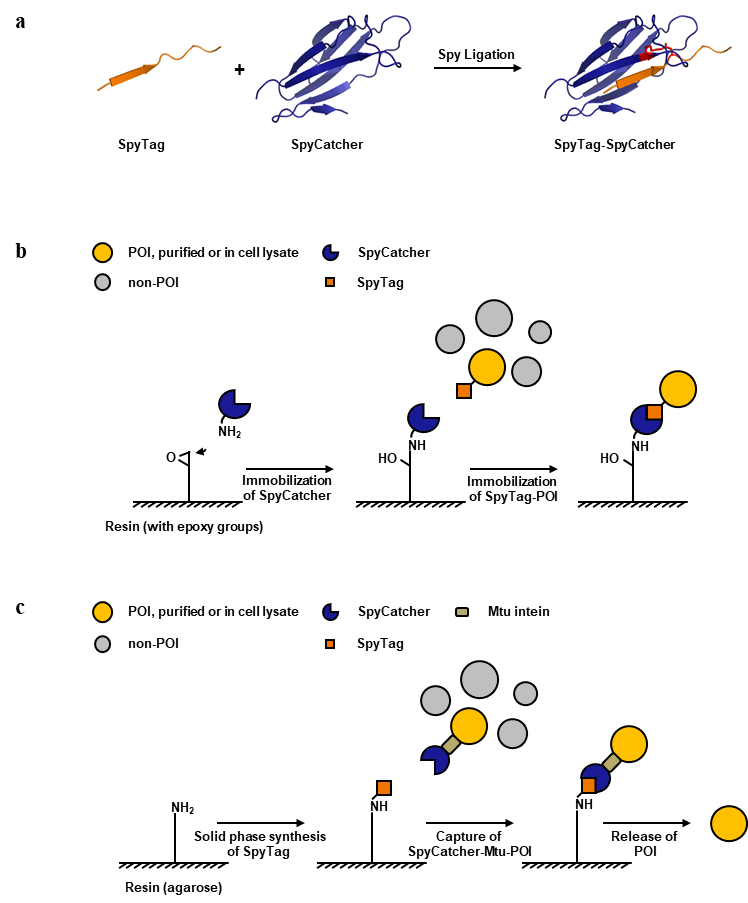
蛋白(酶)的定向固定化(directional immobilization)能最大限度地保持蛋白活力、减少固定化酶的异质化(heterogeneity),在生物催化、临床诊断和蛋白相互作用测定等领域有重要的应用价值,因此一直是生物技术追求的一个目标。标准的固定化方法主要与蛋白表面的赖氨酸或半胱氨酸侧链非特异结合,无法实现定向固定。近年来发展的定向固定新方法,通常需要引入非天然氨基酸、或者使用过量的特殊链接酶等,操作相对复杂、效率较低,没有能达到规模的产业应用要求。
最近,华南理工大学林章凛教授课题组在生物技术的重要杂志《Biotechnology and Bioengineering》发表文章《Spy chemistry-enabled protein directional immobilization and protein purification》,将Spy化学用于蛋白的定向固定化。Spy化学依赖于SpyTag-SpyCatcher连接酶系统,从化脓链球菌(Streptococcus pyogenes)纤连蛋白结合蛋白(fibronectin‐binding protein)的一个结构域改造而来。SpyTag和SpyCatcher可自发反应形成分子间异肽键(Spy化学),已广泛地用于蛋白标记、蛋白偶联、蛋白材料和蛋白拓扑结构的研究中。作者首先将SpyCatcher固定在树脂上,然后通过Spy化学反应直接把带有SpyTag的目标蛋白定向固定在树脂上。作者以工业酶头孢菌素酰化酶等为例,对于纯化的酶或者细胞裂解液的初酶,都能得到约90%的固定化效率和活力回收率,远高于传统的固定化方法(约20%)。该方法预期可以简化固定化酶制备的流程,显著降低成本。SpyTag与SpyCatcher分子都比较小,其中SpyTag为13个氨基酸,SpyCatcher为138个氨基酸,SpyCatcher可以通过成熟的表达体系获得。预期该方法将规模化应用。该工作已在申请国际专利。
作者还基于类似的思路,结合可pH诱导切割的内含肽诱,初步发展了一种蛋白纯化方法,通过简便的捕获-切割,获得纯度大于90%的VHH抗体。对该方法进一步优化,非常有可能为VHH或其它类似抗体的纯化提供新的商业化技术选择。
文章链接:
https://onlinelibrary.wiley.com/doi/abs/10.1002/bit.27460
版权与免责声明:本网页的内容由收集互联网上公开发布的信息整理获得。目的在于传递信息及分享,并不意味着赞同其观点或证实其真实性,也不构成其他建议。仅提供交流平台,不为其版权负责。如涉及侵权,请联系我们及时修改或删除。邮箱:sales@allpeptide.com