点孔成金:黄硕团队《Nature Communications》报道锥形生物纳米孔道内构建的单原子金反应器
在科学与应用领域,金借助其特殊的理化性质扮演了不可或缺的角色。首先,金具备极好的延展性、导电导热性与红外反射性等优越的物理性质,因此被广泛的用作材料的镀层或被用作电子器件中的导线与触点。金亦具备独特的化学性质,可用作反应催化剂或新型药物的制备。而在近年来兴起的纳米科学研究中,金被广泛应用于种类繁多的纳米结构和探针的制备。如我们生活中常见的验孕试纸便是使用了胶体形式的金实现检测汇报。金的三价化合物氯金酸不仅是纳米金的制备前体,也是最常见的金化合物,可以和蛋白质乃至核酸碱基产生相互作用。受限于检测仪器的时空分辨率,科研工作者常用的紫外-可见光谱、质谱和核磁等表征手段并不适用于在单分子水平上深入探究包括Au(III)化合物在内的极小分析物与生物大分子之间的动态相互作用。早期研究表明,氯金酸于水中电离产生的四氯化金离子可以抑制细胞膜上水通道蛋白的活性,然而其机理尚未明确(FEBS letters, 2002, 531(3): 443-447)。这就要求我们发展相应的新型分析方法来更加清晰的观测这些现象。
生物纳米孔技术是近年来发展迅速的单分子研究手段,并已在纳米孔核酸测序领域取得了极为广泛的关注。然而生物纳米孔之所以能够对于核酸上的单个碱基实现分辨,正是源于其超高的动态分辨率,足以分辨小如单个原子的检测分析物。实验中,经过改造的生物纳米孔可以直接被用作纳米反应器,从单分子层面中直接监测化学反应过程。该方向的研究最早可追溯到1997年,英国牛津大学Hagan Bayley课题组通过设计构建工程化溶血素(α-HL)纳米孔,实现了对Zn2+, Cd2+等金属离子与氨基酸残基配位反应的单分子观测(Chemistry & biology, 1997, 4(7): 497-505.)。但是受限于α-HL孔道的直桶圆柱形识别位点与较宽的孔体尺度,所有观测到的信号都表现为极微弱的阻塞信号浮动(2-3 pA)。迄今为止,所有的基于生物孔道的单分子反应器均由溶血素(α-HL)纳米孔构建而成。
我院化学化工学院黄硕团队在近期研究探索中意外发现Au(III)离子可以通过可逆的Au(III)-硫醚配位作用,与野生型α-HL纳米孔中的甲硫氨酸残基(M113)结合。但正如之前提到的,溶血素对于金属离子的检测信号较小,多元离子[AuCl4]-给出电流阻塞信号也只有5-6 pA,且检测信号具有多种无规则波动,可能来源于Au(III)离子与直筒状识别位点内其它氨基酸(如赖氨酸)的非特异性相互作用所致。受到纳米孔测序技术的启发,黄硕团队通过单个定点突变,将具有锥形识别位点的耻垢分枝杆菌孔蛋白A(MspA)纳米孔内腔中引入了甲硫氨酸,从而将该反应有目的的移植到了MspA纳米孔最尖锐的识别位点,即91号位点处,并观测到了对应的单分子反应信号(图1,动图1)。
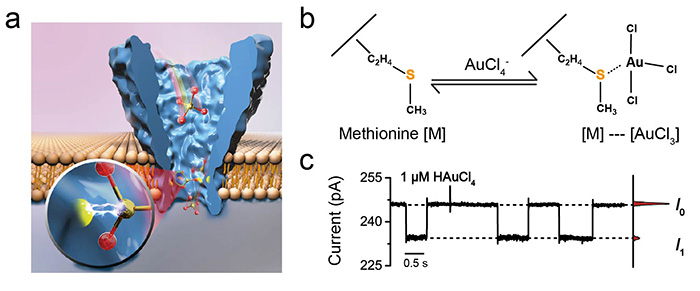
图1: MspA的单个[AuCl4]-离子传感信号。(a).实验示意图。(b). Au(III)-硫醚配位的分子模型展示。(c).100 mV下1 μM [AuCl4]-离子的传感信号。(图片来源自该作者)。
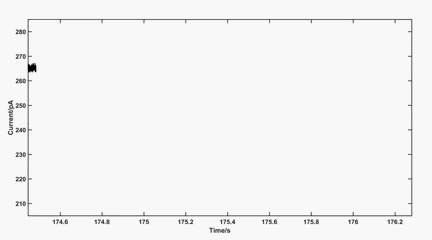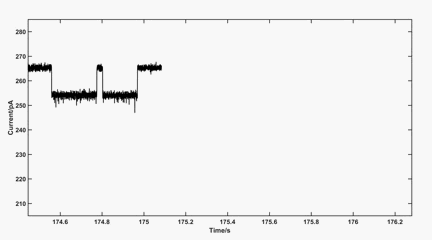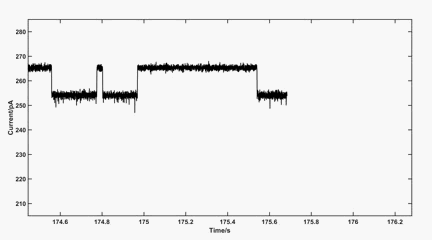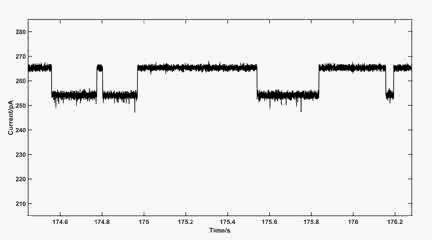
动图1:100 mV下MspA的单个金离子传感信号
与α-HL的桶状构型相比,MspA整体呈锥形,其开阔的前庭可以引入更多的离子电流从而放大检测信号,其狭窄的识别位点则提供了更高的空间分辨率,大大削弱了周围氨基酸的干扰。在最大检测电压下,该单分子检测信号可以达到55 pA(图2), 也是目前报道过的最大的纳米孔单离子检测信号。
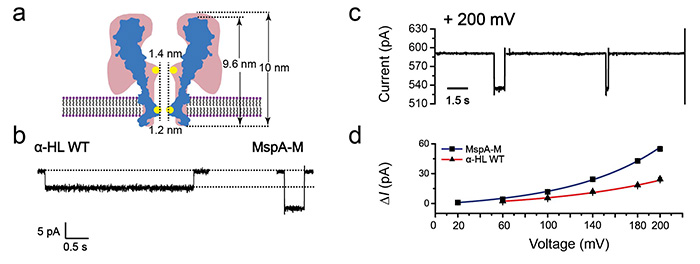
图2:α-HL和MspA的单个[AuCl4]-离子信号比对。(a). α-HL和MspA的构型对比。α-HL的构型为桶状构型,MspA则为锥形构型.。(b). 100 mV 下α-HL和MspA的典型 [AuCl4]-离子信号展示。(c). 200 mV下MspA给出的[AuCl4]-离子信号。(d) 不同电压下(20-200 mV) α-HL和MspA的的单个[AuCl4]-离子堵孔深度比较。(图片来源自该作者)。
众所周知,基于生物表达制备的生物纳米孔道只可能形成20种天然氨基酸的空间组合。传统的定点突变工程无法给生物纳米孔到带来任何氨基酸以外的化学性质。而在单个金原子镶嵌孔道内时,MspA纳米孔便具备了单个金原子的化学特性,形成了一个金原子内嵌的黄金生物孔道,从而获得了新的传感功能,并可以直接对多种生物硫醇如L-半胱氨酸(Cysteine, Cys),L-高半胱氨酸(Homocysteine, Hcy)和L-谷胱甘肽(Glutathione, GSH)进行单分子区分。生物硫醇分子具有活泼的巯基官能团,可以与[AuCl4]-离子形成更强的Au(III)-硫醇的相互作用,这样,内嵌于孔内的金离子,可以作为一座金原子桥,一端连接纳米孔上的硫醚,一端连接游离的硫醇分子,从而根据其独特的反应中间状态汇报生物硫醇的检测信息(图3,动图2)。该传感机制简单,无需标记,检测快速且经济高效,有希望设计为便携式传感器芯片用于临床上的检测。并且,Au(III)离子的嵌入可以为其他许多基础科学研究项目提高思路,如启发药物分子靶点的设计,或设计更多的金属内嵌修饰构建一系列金属生物孔道(Metalloporin)来识别其它对应分析物,从而拓宽生物纳米孔的单分子检测功能,并有希望推进基于孔道的单分子蛋白质测序研究。
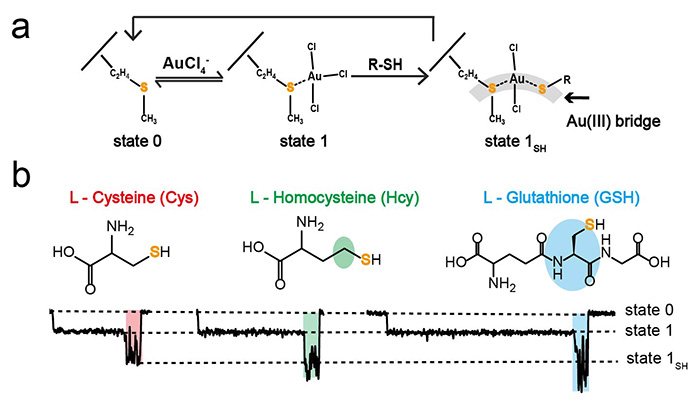
图3:生物硫醇传感机理和对应传感信号。(a).生物硫醇传感机理的分子模型展示。(b). 半胱氨酸、同型半胱氨酸、谷胱甘肽的分子结构式及对应的传感信号。(图片来源自该作者)。
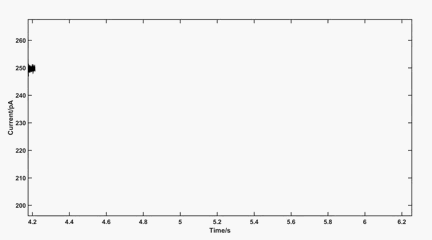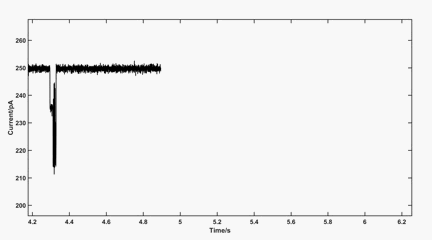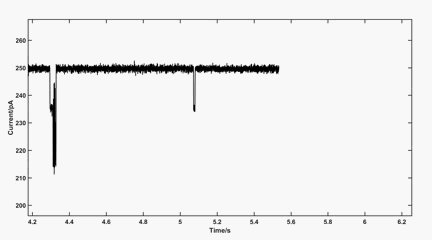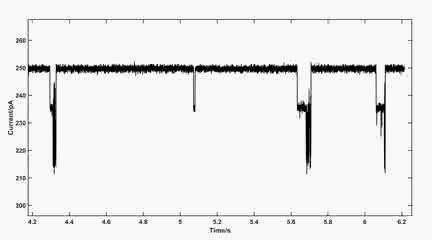
动图2:100 mV下MspA中金桥联的半胱氨酸传感信号
该工作以“Giant single molecule chemistry events observed from a tetrachloroaurate(III) embedded Mycobacterium smegmatis porin A nanopore”为题,于2019年12月11日在《Nature Communications》发表相关论文(DOI: 10.1038/s41467-019-13677-2,文章链接:https://www.nature.com/articles/s41467-019-13677-2)。我院化学化工学院博士生曹姣为该论文第一作者,黄硕教授为该论文通讯作者。此项研究得到了国家自然科学基金(项目编号:91753108、21327902、21675083、31972917)、中央高校基本科研业务费(国际科技合作促进项目)(项目编号: 020514380142、020514380174)、生命分析化学国家重点实验室(项目编号:5431ZZXM1804、5431ZZXM1902)、南京大学卓越计划 (项目编号:ZYJH004)、中组部青年海外高层次人才计划、江苏省高层次创业创新人才引进计划和南京大学科技创新基金项目等经费支持。本工作在发表过程中获得了我院陈洪渊院士、郭子建院士、赵劲教授、朱少林教授与朱从青教授的诸多宝贵意见。
版权与免责声明:本网页的内容由收集互联网上公开发布的信息整理获得。目的在于传递信息及分享,并不意味着赞同其观点或证实其真实性,也不构成其他建议。仅提供交流平台,不为其版权负责。如涉及侵权,请联系我们及时修改或删除。邮箱:sales@allpeptide.com