最新研究成果 | 陈立功课题组发文揭示神经外单胺转运体作为脂肪细胞儿茶酚胺清除新机制
时间:2021-04-09 00:40:02学院:药学院学校:清华大学
2019年1月17日,清华大学药学院陈立功课题组在《公共科学图书馆.生物学》(PLOS Biology)在线发表了题为《3型有机阳离子转运蛋白作为一种新型脂肪细胞儿茶酚胺类物质运载途径并介导白色脂肪棕色化过程》(Organic cation transporter 3 (Oct3) is a distinct catecholamines clearance route in adipocytes mediating the beiging of white adipose tissue )的研究论文。该研究首次发现白色脂肪细胞可通过3型阳离子转运蛋白转运儿茶酚胺类物质,最终调控白色脂肪的棕色化。
该项研究获得PLOS Biology杂志和审稿人的高度关注,被选为本期亮点文章。PLOS Biology杂志以 “阻断荷尔蒙摄取增加脂肪燃烧(Blocking Hormone Uptake Burns More Fat)”为题专门进行了新闻发布会向国际媒体予以报道。同时,纽约西奈山伊坎医学院著名代谢研究专家Christoph Buettner教授主动撰写“脂肪细胞吞噬去甲肾上腺素(Fat cells gobbling up norepinephrine)”为题对该文章进行点评。
肥胖是导致糖尿病、脂肪肝以及心血管疾病的重要诱因之一,据报道全世界大约有10%的人口患有肥胖或肥胖相关的代谢疾病。脂肪组织主要分为三类:⽩⾊脂肪组织(White adipose tissues,WAT), 棕⾊脂肪组织(Brown adipose tissues,BAT), ⽶⾊脂肪组织(Beige adipose tissues)。棕⾊脂肪和⽶⾊脂肪⾼表达解偶联蛋⽩Ucp1,可以将能量以热量的形式释放,因此对维持机体体温具有重要作⽤。其中米色脂肪存在于白色脂肪组织中,受到寒冷等刺激后,其功能将向棕色脂肪的方向发生转变。在脂肪棕⾊化过程中,⼉茶酚胺类物质发挥重要的生物学功能,可通过β-AR-cAMP-PKA通路,激活产热基因的表达,引起脂肪棕⾊化转变。以前研究认为,脂肪组织中的儿茶酚胺的清除主要由交感神经元和巨噬细胞表面的SLC6A2完成。但考虑到SLC6A2最大转运能力较低,单一转运机制能否满足寒冷刺激下儿茶酚胺类物质的代谢需求,仍然需要进一步探究。
之前的研究揭示脂肪很可能在儿茶酚胺物质的代谢清除中发挥重要的作用。一方面通过脂肪组织后血液中儿茶酚胺的浓度会降低,另一方面脂肪本身表达高丰度和高活性的儿茶酚胺代谢酶,并且脂肪细胞中儿茶酚胺的转运过程可以被OCT3的抑制剂阻断。以上研究都显示脂肪细胞中很可能存在有一种不同于传统SLC6A2介导的儿茶酚胺类物质转运机制。
溶质载体(solute carrier, SLC)构成最大的膜转运蛋白家族,在多种底物的跨膜运输中发挥着重要的角色。其中,3型有机阳离子转运蛋白(Organic cation transpoter, OCT3)可以介导很多体内重要的内源性胺类物质和某些重要药物的转运过程。2009年,Nature Genetics上发表了一篇针对冠状动脉粥样硬化性心脏病(coronary adtery disease,CAD)的全基因组单倍型关联研究(genome-wide haplotype association study, GWHA),研究人员发现位于6q26-q27区域的OCT3-LPAL2-LPA基因为CAD的强易感基因,但并未进一步阐述其中的分子发病机制。
在本篇研究中,陈立功课题组发现脂肪细胞高表达3型阳离子转运蛋白和儿茶酚胺类物质代谢酶,具备代谢儿茶酚胺的分子基础。通过体外同位素标记的底物转运实验,发现脂肪细胞的Oct3可以高效转运包含去甲肾上腺素在内的儿茶酚胺类物质,并且具有⾼转运能⼒、低亲和⼒的转运特性。然而在动物体内Oct3蛋白是否能介导脂肪内儿茶酚胺类物质的清除呢?为了解答这一问题,陈立功课题组通过外源阻断脂肪内交感神经,排除了交感神经上的转运机制干扰,发现在这种情况下,敲除了Oct3的白色脂肪呈现儿茶酚胺类物质蓄积显著减少的现象,但在棕色脂肪中这种现象并不明显,因此他们认为Oct3主要在白色脂肪中完成对儿茶酚胺类物质的转运。
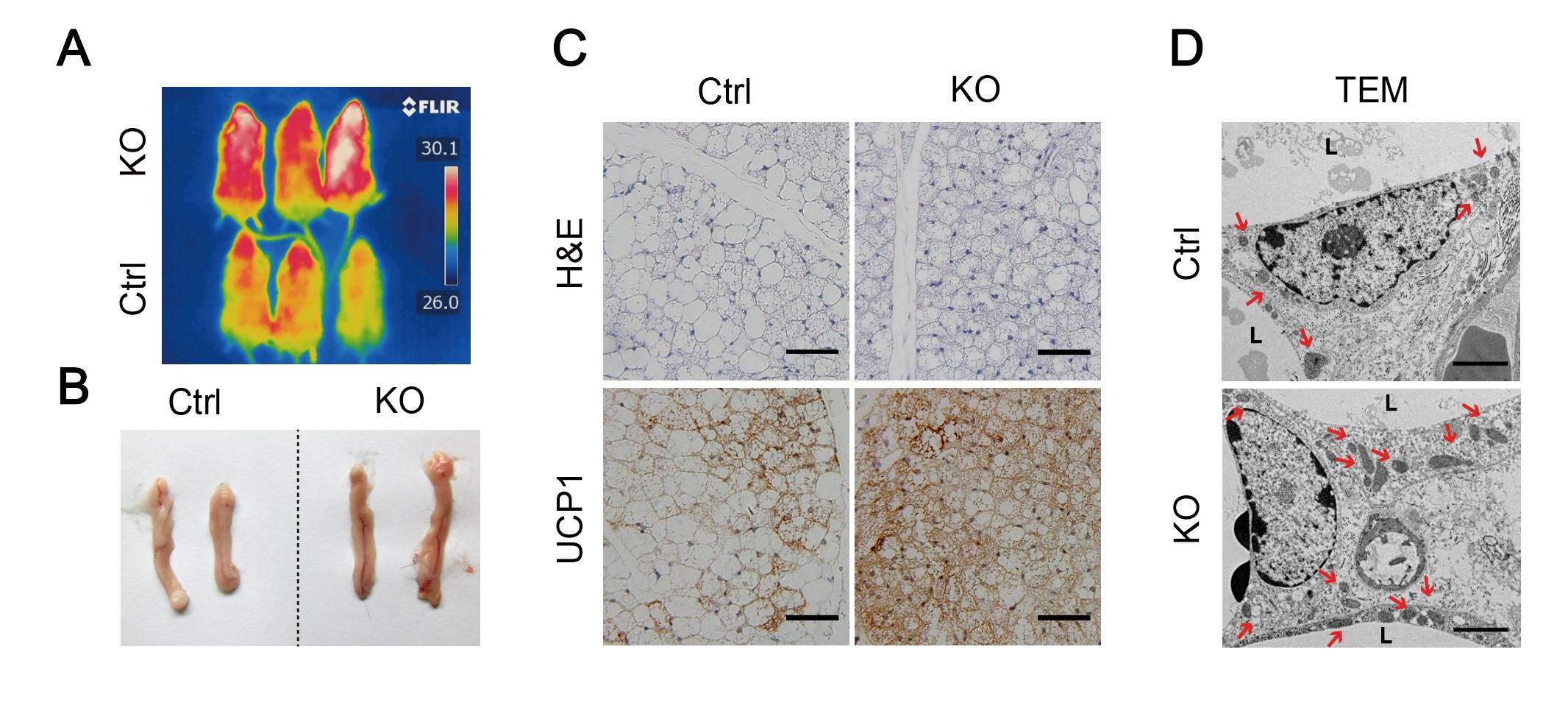 图 1 敲除小鼠与对照小鼠寒冷刺激后的代谢变化
图 1 敲除小鼠与对照小鼠寒冷刺激后的代谢变化
那么依赖于Oct3的儿茶酚胺转运机制是否会参与到小鼠整体代谢产热过程中呢?该课题组选择了4摄氏度的寒冷刺激小鼠模型,在该模型下,敲除该蛋白小鼠能维持更高体温(图1A),皮下白色脂肪呈现更明显的脂肪色化现象(图1B和1C),并使得包含产热、脂肪酸氧化、糖酵解在内的一系列基因表达上调,线粒体数目增多(图1D),整体能量消耗增加,最终增强机体产热过程,并且这一过程依赖于β-AR-cAMP-PKA通路。该研究指明了脂肪细胞内存在转运儿茶酚胺类物质的关键蛋白Oct3,区别于之前已经报道的交感神经末梢以及脂肪巨噬细胞中的转运机制,填补了该领域在白色脂肪米色化以及交感神经信号负向调控通路的空白。在该研究提供的基础上,探索清楚β-AR-PKA-Creb通路的上下游及其与脂肪相关的神经、免疫系统的网络联系,将为今后的脂肪棕色化研究提供重要的科学支撑。发展针对OCT3的特异性抑制剂或者抗体有望为肥胖和糖尿病等代谢疾病提供新的治疗途径!
 图 2 脂肪细胞中OCT3可介导儿茶酚胺类物质的转运
图 2 脂肪细胞中OCT3可介导儿茶酚胺类物质的转运
PLOS Biology为JCR分区一区杂志并为自然指数期刊。清华大学药学院博士生宋文欣和罗琪为本论文的共同第一作者,陈立功研究员与加州大学旧金山分校Kathleen M. Giacomini教授为论文的共同通讯作者。 该研究得到了国家重点研发计划、国家重大新药创制项目以及国家自然科学基金的资助。
文章链接:https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.2006571
该项研究获得PLOS Biology杂志和审稿人的高度关注,被选为本期亮点文章。PLOS Biology杂志以 “阻断荷尔蒙摄取增加脂肪燃烧(Blocking Hormone Uptake Burns More Fat)”为题专门进行了新闻发布会向国际媒体予以报道。同时,纽约西奈山伊坎医学院著名代谢研究专家Christoph Buettner教授主动撰写“脂肪细胞吞噬去甲肾上腺素(Fat cells gobbling up norepinephrine)”为题对该文章进行点评。
肥胖是导致糖尿病、脂肪肝以及心血管疾病的重要诱因之一,据报道全世界大约有10%的人口患有肥胖或肥胖相关的代谢疾病。脂肪组织主要分为三类:⽩⾊脂肪组织(White adipose tissues,WAT), 棕⾊脂肪组织(Brown adipose tissues,BAT), ⽶⾊脂肪组织(Beige adipose tissues)。棕⾊脂肪和⽶⾊脂肪⾼表达解偶联蛋⽩Ucp1,可以将能量以热量的形式释放,因此对维持机体体温具有重要作⽤。其中米色脂肪存在于白色脂肪组织中,受到寒冷等刺激后,其功能将向棕色脂肪的方向发生转变。在脂肪棕⾊化过程中,⼉茶酚胺类物质发挥重要的生物学功能,可通过β-AR-cAMP-PKA通路,激活产热基因的表达,引起脂肪棕⾊化转变。以前研究认为,脂肪组织中的儿茶酚胺的清除主要由交感神经元和巨噬细胞表面的SLC6A2完成。但考虑到SLC6A2最大转运能力较低,单一转运机制能否满足寒冷刺激下儿茶酚胺类物质的代谢需求,仍然需要进一步探究。
之前的研究揭示脂肪很可能在儿茶酚胺物质的代谢清除中发挥重要的作用。一方面通过脂肪组织后血液中儿茶酚胺的浓度会降低,另一方面脂肪本身表达高丰度和高活性的儿茶酚胺代谢酶,并且脂肪细胞中儿茶酚胺的转运过程可以被OCT3的抑制剂阻断。以上研究都显示脂肪细胞中很可能存在有一种不同于传统SLC6A2介导的儿茶酚胺类物质转运机制。
溶质载体(solute carrier, SLC)构成最大的膜转运蛋白家族,在多种底物的跨膜运输中发挥着重要的角色。其中,3型有机阳离子转运蛋白(Organic cation transpoter, OCT3)可以介导很多体内重要的内源性胺类物质和某些重要药物的转运过程。2009年,Nature Genetics上发表了一篇针对冠状动脉粥样硬化性心脏病(coronary adtery disease,CAD)的全基因组单倍型关联研究(genome-wide haplotype association study, GWHA),研究人员发现位于6q26-q27区域的OCT3-LPAL2-LPA基因为CAD的强易感基因,但并未进一步阐述其中的分子发病机制。
在本篇研究中,陈立功课题组发现脂肪细胞高表达3型阳离子转运蛋白和儿茶酚胺类物质代谢酶,具备代谢儿茶酚胺的分子基础。通过体外同位素标记的底物转运实验,发现脂肪细胞的Oct3可以高效转运包含去甲肾上腺素在内的儿茶酚胺类物质,并且具有⾼转运能⼒、低亲和⼒的转运特性。然而在动物体内Oct3蛋白是否能介导脂肪内儿茶酚胺类物质的清除呢?为了解答这一问题,陈立功课题组通过外源阻断脂肪内交感神经,排除了交感神经上的转运机制干扰,发现在这种情况下,敲除了Oct3的白色脂肪呈现儿茶酚胺类物质蓄积显著减少的现象,但在棕色脂肪中这种现象并不明显,因此他们认为Oct3主要在白色脂肪中完成对儿茶酚胺类物质的转运。
 图 1 敲除小鼠与对照小鼠寒冷刺激后的代谢变化
图 1 敲除小鼠与对照小鼠寒冷刺激后的代谢变化
(A)小鼠体温(B-C)脂肪形态变化以及Ucp1免疫组化染色 (D)电镜下脂肪以及线粒体形态,箭头所指为线粒体。
那么依赖于Oct3的儿茶酚胺转运机制是否会参与到小鼠整体代谢产热过程中呢?该课题组选择了4摄氏度的寒冷刺激小鼠模型,在该模型下,敲除该蛋白小鼠能维持更高体温(图1A),皮下白色脂肪呈现更明显的脂肪色化现象(图1B和1C),并使得包含产热、脂肪酸氧化、糖酵解在内的一系列基因表达上调,线粒体数目增多(图1D),整体能量消耗增加,最终增强机体产热过程,并且这一过程依赖于β-AR-cAMP-PKA通路。该研究指明了脂肪细胞内存在转运儿茶酚胺类物质的关键蛋白Oct3,区别于之前已经报道的交感神经末梢以及脂肪巨噬细胞中的转运机制,填补了该领域在白色脂肪米色化以及交感神经信号负向调控通路的空白。在该研究提供的基础上,探索清楚β-AR-PKA-Creb通路的上下游及其与脂肪相关的神经、免疫系统的网络联系,将为今后的脂肪棕色化研究提供重要的科学支撑。发展针对OCT3的特异性抑制剂或者抗体有望为肥胖和糖尿病等代谢疾病提供新的治疗途径!
 图 2 脂肪细胞中OCT3可介导儿茶酚胺类物质的转运
图 2 脂肪细胞中OCT3可介导儿茶酚胺类物质的转运PLOS Biology为JCR分区一区杂志并为自然指数期刊。清华大学药学院博士生宋文欣和罗琪为本论文的共同第一作者,陈立功研究员与加州大学旧金山分校Kathleen M. Giacomini教授为论文的共同通讯作者。 该研究得到了国家重点研发计划、国家重大新药创制项目以及国家自然科学基金的资助。
文章链接:https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.2006571
版权与免责声明:本网页的内容由收集互联网上公开发布的信息整理获得。目的在于传递信息及分享,并不意味着赞同其观点或证实其真实性,也不构成其他建议。仅提供交流平台,不为其版权负责。如涉及侵权,请联系我们及时修改或删除。邮箱:sales@allpeptide.com