杨武利课题组发展出近红外光响应的一氧化氮纳米发生器用于逆转肿瘤的多药耐药性
近日,杨武利教授课题组提出了利用光热效应释放一氧化氮(NO)气体分子用于耐药型肿瘤治疗的新策略。通过将具有良好光热效果的纳米载体和热敏感的NO供体结合,构建了一种新型NO纳米发生器,实现了近红外光照射下精准可控的NO释放,再结合靶向分子,该纳米平台可有效靶向肿瘤部位同时逆转肿瘤的多药耐药性,从而增强化疗效果,为耐药型肿瘤的治疗提供了新途径,对NO相关的疾病治疗也具有重要意义。该工作最近发表在《先进功能材料》(Advanced Functional Materials)上,详见:Ranran Guo, Ye Tian, Yajun Wang, and Wuli Yang*. Near-infrared Laser-Triggered Nitric Oxide Nanogenerators for the Reversal of Multidrug Resistance in Cancer. Advanced Functional Materials, 2017, 27, 1606398.
文章链接:http://onlinelibrary.wiley.com/doi/10.1002/adfm.201606398/full
一氧化氮(NO)是人体内重要的气体信号分子,它在血管平滑肌舒张,血小板黏附,炎症和免疫反应,神经传递等多种生命活动中发挥着重要作用。近年来,利用NO这类气体分子治疗相关疾病被认为是一种新型的治疗手段,具有广阔的应用前景,然而,如何实现NO分子在体内的运输以及准确的控制释放仍然是一个巨大的难题。
为了解决这一问题,杨武利教授团队构建了独特的近红外光响应的NO纳米发生器。利用光热试剂和热敏感NO供体结合,在808 nm的近红外光照射下,该纳米平台可以将光能有效转化为热能,从而促进热敏感的供体释放NO(图 1)。
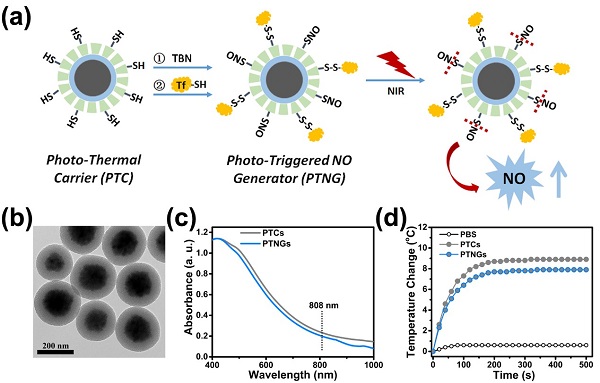
图1. NO纳米发生器的构建示意图
他们在研究过程中发现, NO的释放过程对近红外光具有良好的响应,在体外表现出明显的off/on行为,并利用激光共聚焦进一步在细胞水平上验证了NO响应释放的能力(图2);之后他们将该NO释放平台用于耐药型癌症的治疗。细胞实验结果表明产生的NO分子能够抑制耐药型癌细胞的P型糖蛋白表达,从而有效提高细胞内化疗药物的富集,增强杀伤效果;在耐药型肿瘤模型的裸鼠实验中,这一结果被再次证实,实验组的肿瘤生长得到了有效控制。这种近红外光响应释放NO的纳米平台对于耐药型肿瘤和其它NO相关疾病的治疗具有重要意义。

图2. NO的释放检测: (a) 近红外光照射下(808 nm, 0.3 W·cm-2, 5 min), NO释放的off/on行为;(b) 利用荧光探针DAFDA检测细胞内NO产生的激光共聚焦图像。
版权与免责声明:本网页的内容由收集互联网上公开发布的信息整理获得。目的在于传递信息及分享,并不意味着赞同其观点或证实其真实性,也不构成其他建议。仅提供交流平台,不为其版权负责。如涉及侵权,请联系我们及时修改或删除。邮箱:sales@allpeptide.com