何爱彬研究组揭示心肌细胞核小体更新机制阅读次数:
何爱彬研究组揭示心肌细胞核小体更新机制
2019年5月20日,北京大学分子医学研究所,北京大学-清华大学生命科学联合中心研究员何爱彬研究组与分子医学研究所李川昀研究组合作在《Circulation Research》杂志在线发表题为“Replication-independent histone turnover underlines the epigenetic homeostasis in adult heart”的研究成果。该研究发现与不增殖成体心肌细胞的较长寿命相比,复制非依赖型的核小体更新较快;该机制可控制调控区域的组蛋白乙酰化修饰水平,对心脏功能稳态起重要作用。这一成果为理解心脏中的表观遗传调控及心脏疾病的治疗提供了理论基础。(原文链接:https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.118.314366)。
在真核生物中,DNA缠绕在组蛋白八聚体上形成核小体。但核小体与DNA的结合并非一成不变的,而是会经历动态的组装和解聚过程(核小体/组蛋白更新),这一过程可以为调控因子提供接近并结合DNA的机会。DNA的复制伴随着具有特定修饰的组蛋白的解聚和组装,其中包含新合成的组蛋白修饰准确复制到子代细胞。因此之前研究组蛋白更新对表观遗传稳态的精确调控必定会受到DNA复制伴随的被动组蛋白稀释(passive dilution of histone marks)的干扰。
该论文巧妙地选用几乎不增殖的小鼠成体心肌细胞为研究对象,运用H2B-GFP脉冲追踪实验,对复制非依赖型组蛋白更新的功能及调控机制进行了探究。此方法在避免了DNA复制影响的同时,实现了在体、全基因组水平的组蛋白更新研究。研究结果发现心肌细胞中组蛋白快速更新区域富集了活跃转录的基因及顺式调控元件。进一步,以增强子为研究对象,该研究阐明了染色质修饰因子EED可通过与染色质重塑因子BRG1相互作用,来调节组蛋白更新速率,进而改变H3K27ac修饰水平,影响增强子的活性。这些研究成果对于理解哺乳动物正常组织中表观遗传环境的维持及动态调控具有重要的意义。
北京大学分子医学研究所博士生李玉梅、艾珊珊及生命科学联合中心博士生余先红担任论文共同第一作者。分子医学研究所的何爱彬研究员、李川昀研究员为本文的通讯作者。该研究获得了科技部干细胞专项、国家自然科学基金委的和生命科学联合中心的支持。
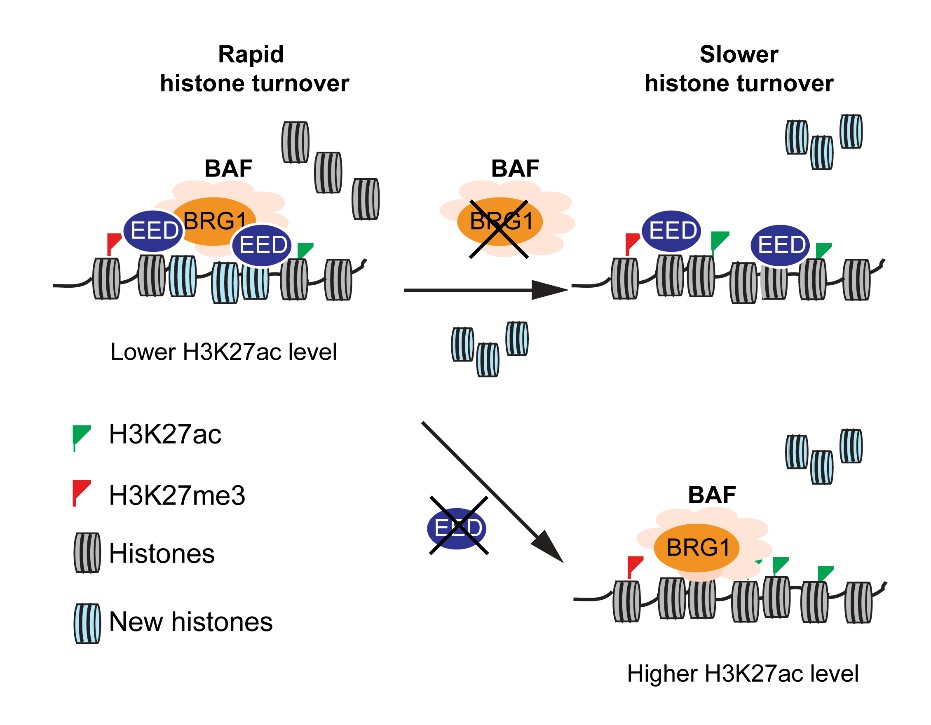
EED调控复制非依赖型组蛋白更新速率的模式图
版权与免责声明:本网页的内容由收集互联网上公开发布的信息整理获得。目的在于传递信息及分享,并不意味着赞同其观点或证实其真实性,也不构成其他建议。仅提供交流平台,不为其版权负责。如涉及侵权,请联系我们及时修改或删除。邮箱:sales@allpeptide.com