鞠熀先教授研究组在癌症靶向成像诊治研究方面取得重要进展
时间:2021-04-11 16:51:03学院:化学化工学院学校:南京大学
|
目前,癌症的发病率和死亡率一直居高不下,严重威胁着人类的健康和生命。寻找有效的癌症诊疗靶点并发展高效的诊疗方法已成为该领域的重要研究方向。传统的癌症诊治是两个独立的过程,难以从分子水平对癌症治疗过程中的生理变化进行实时监测,易导致治疗不足或过度治疗。因此,迫切需要开发新型诊疗一体化试剂,从分子水平对癌症进行原位诊治并对疗效进行实时监测。
我院鞠熀先教授研究组在973计划“仿生分子识别技术在生物医学应用的基础研究”(2010-2014)与国家自然科学基金创新研究群体(2006-2014)和重点项目(2012-2016)等资助下,在癌症靶向成像诊治研究方面取得了重要进展。他们以癌细胞内溶酶体为成像监测与治疗的共同靶点,设计合成了一种表面修饰核酸适体、内部包埋pH激活荧光探针和近红外卟啉光敏剂的多功能纳米胶束(Apt-TNP),成功实现了癌症原位成像、治疗和疗效实时监测的目标。该纳米胶束能在核酸适体的介导下特异性识别癌细胞,经内吞作用进入癌细胞溶酶体,溶酶体内独特的酸性pH环境(pH 4.5–5.0)激活荧光探针产生强的荧光信号,实现对癌细胞的高信噪比成像。在近红外光照射下,光敏剂介导生成具有细胞毒性的单线态氧,破坏溶酶体结构,导致组织蛋白酶释放促使癌细胞以溶酶体途径凋亡(图1)。在溶酶体破裂过程中伴随着质子的释放,使荧光探针的荧光减弱,由此可对治疗效果进行实时监测(图2)。活体实验表明,该纳米胶束可在癌组织高效富集并产生强荧光信号;近红外光照射后,癌组织逐渐消失,荧光信号显著降低(图3),可以方便地监测疗效。论文由该课题组11级博士生田蒋为和丁霖副教授为共同第一作者,鞠熀先教授、于俊生教授和厦门大学杨朝勇教授为通讯作者完成,于2014年7月15日在线发表(Angew. Chem. Int. Ed.DOI:10.1002/anie.201405490)。这是该课题组继去年底提出一种有“开-关”可控生成单线态氧能力的pH激活型光敏剂,并成功实现肿瘤高效、高选择性的光动力治疗(J. Am. Chem. Soc. 2013, 135, 18850)的进一步发展,对癌症诊断、治疗以及疗效监测技术的发展具有实用意义。
癌症靶向成像与治疗的发展离不开细胞内肿瘤相关功能分子原位检测技术的建立。该课题组在细胞内端粒酶、microRNA等分子的原位检测方面也取得了连续进展,构建了多种特异性识别细胞内microRNA(Biomaterials 2011, 32, 3875; Angew. Chem. Int. Ed. 2012, 51, 4607; Chem. Rev.2013, 113, 6207; PlosOne 2013, 8, e65540)和端粒酶的“开-关”可控型纳米探针(J. Am. Chem. Soc. 2013, 135, 13282; J. Am. Chem. Soc. 2014, 136, 8205),实现了细胞内microRNA与端粒酶活性的原位定量检测,可用于区分正常和肿瘤细胞,以及抗癌药物的筛选。
 图1. Apt-TNP结构及以溶酶体为靶点的癌症成像、光动力治疗和疗效监测示意图
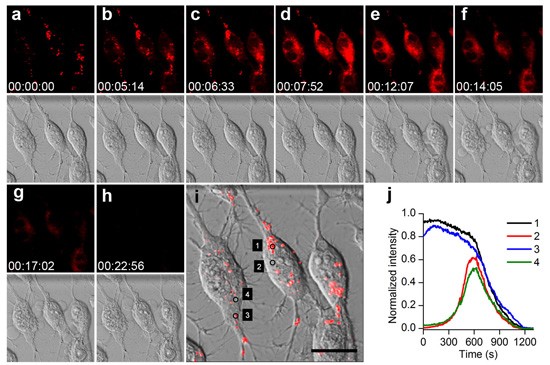 图2.细胞水平的成像、光动力治疗及疗效监测
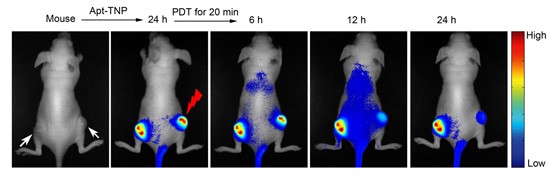 图3.活体水平的成像、光动力治疗及疗效监测
|
版权与免责声明:本网页的内容由收集互联网上公开发布的信息整理获得。目的在于传递信息及分享,并不意味着赞同其观点或证实其真实性,也不构成其他建议。仅提供交流平台,不为其版权负责。如涉及侵权,请联系我们及时修改或删除。邮箱:sales@allpeptide.com