金腾川团队首次揭示金属离子激活寨卡病毒NS3解旋酶激活的分子机制
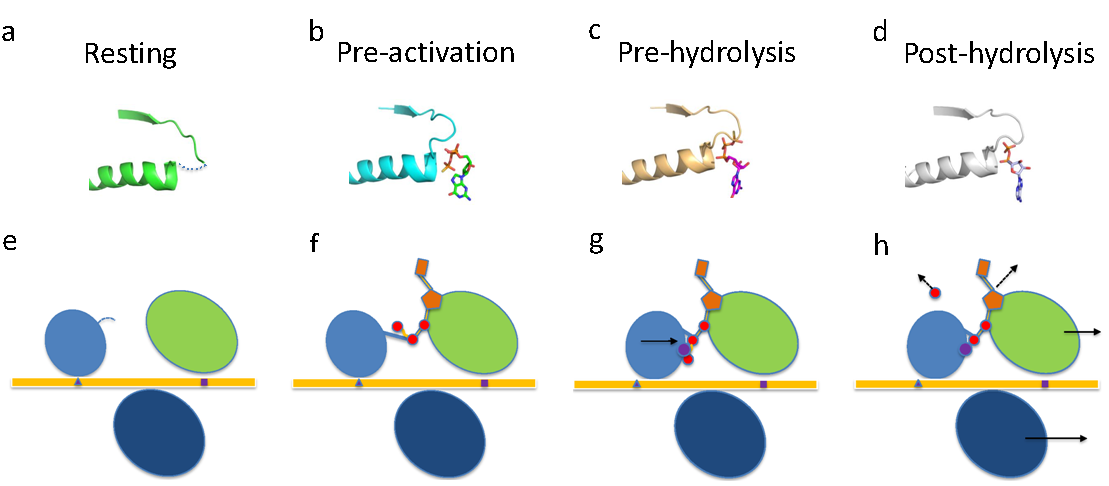
中国科学技术大学生命科学学院金腾川课题组利用X晶体衍射技术,首次清晰捕捉到寨卡病毒解旋酶只结合三磷酸核苷(NTP)、与NTP-金属离子结合后的激活初始态及NTP水解后的状态,成功揭示了金属离子激活寨卡病毒NS3解旋酶的分子机制。研究成果以“Molecular Mechanism of Divalent-Metal-Induced Activation of NS3 Helicase and Insights into Zika Virus Inhibitor Design”为题,于10月19日在线发表于《Nucleic Acids Research》杂志。
寨卡病毒感染由于能造成新生儿小头畸形及格林-巴利综合症等神经系统病变而被推上风口浪尖,目前已经引起了全球广泛的关注,并于2016年2月被世界卫生组织列为国际突发公共卫生事件。根据最新疫情和研究报告,寨卡病毒正在向亚洲扩散,已经构成亚太地区的新威胁。但是还没有有效的药物来预防和对抗这种病毒感染。据介绍,中科院前沿科学与教育局对寨卡病毒防控高度重视,与2016年2月17日在上海巴斯德研究所召开了寨卡病毒防控应急研究研讨会。中国科技大学的团队也积极参与了寨卡病毒基础生物学的研究。
寨卡NS3解旋酶在病毒复制过程对RNA的解旋、复制起重要作用,而腺苷和金属离子是解旋酶执行功能所必须的组分。该项研究的发现,很好地解释了国外专家在其他病毒研究中发现的奇特现象,只有NTP不仅不能推动病毒解旋酶的工作,反而抑制了其活性。因此该工作揭示的这个机制,不只局限于寨卡病毒解旋酶,还适用于其它黄热病毒家族。该项研究首次为金属离子-NTP对NS3解旋酶激活的变构调节提供了结构证据,为治疗寨卡病毒感染的药物设计提供了精细的结构信息。
该工作的共同第一作者为2016级硕士研究生曹晓聪和金腾川课题组博士后李亚娟博士。据金腾川老师介绍,曹晓聪同学是从东北大学以专业第一的成绩,报送到科大生科院读研究生。2015年底确定保研以后,就加入该课题组,在李亚娟博士带领下,参与了寨卡病毒课题的攻关。该工作还得到了斯坦福大学郭峰博士(9808校友)的支持。该项研究得到了博士后基金和中科院天然免疫与慢性病重点实验室开放课题的资助。该工作引起了较广泛的社会关注,其中新华社和科学网都对这个工作进行了报道。《中国科学》杂志邀请美国德州大学健康科学中心的项焰教授对该工作做了亮点点评。
http://www.gov.cn/xinwen/2016-10/14/content_5119239.htm
http://news.sciencenet.cn/htmlnews/2016/10/359034.shtm
ABSTRACT
Zika virus has attracted increasing attention because of its potential for causing human neural disorders, including microcephaly in infants and Guillain–Barré syndrome. Its NS3 helicase domain plays critical roles in NTP-dependent RNA unwinding and translocation during viral replication. Our structural analysis revealed a pre-activation state of NS3 helicase in complex with GTPγS, in which the triphosphate adopts a compact conformation in the absence of any divalent metal ions. In contrast, in the presence of a divalent cation, GTPγS adopts an extended conformation, and the Walker A motif undergoes substantial conformational changes. Both features contribute to more extensive interactions between the GTPγS and the enzyme. Thus, this study provides structuralevidence on the allosteric modulation of MgNTP2- on the NS3 helicase activity. Furthermore, the compact conformation of inhibitory NTP identified in this study provides precise information for the rational drug design of small molecule inhibitors for the treatment of ZIKV infection.
版权与免责声明:本网页的内容由收集互联网上公开发布的信息整理获得。目的在于传递信息及分享,并不意味着赞同其观点或证实其真实性,也不构成其他建议。仅提供交流平台,不为其版权负责。如涉及侵权,请联系我们及时修改或删除。邮箱:sales@allpeptide.com