课题组网址:https://www.mls.ls.tum.de/pbch/home/
我们的研究旨在了解蛋白质和多肽的生物分子相互作用通过肽化学介导生物学和疾病相关的过程,并开发新的分子和工具来控制或可视化这些过程。
我们特别有兴趣理解介导淀粉样蛋白错误折叠和相关细胞变性的蛋白质相互作用,以及设计基于肽的分子和化学方法来抑制这些过程。我们还有兴趣表征动脉粥样硬化中的促炎性趋化因子相互作用,并设计肽来调节这些相互作用并控制它们的作用。我们正在使用蛋白质(肽)化学设计和合成策略以及广泛的生化和生物物理方法。
当前的研究活动目的是:
了解蛋白质错误折叠和淀粉样蛋白自组装潜在的细胞变性和蛋白质聚集疾病的发病机理,阿尔茨海默氏病(AD)和II型糖尿病(T2D)。
设计基于肽的分子以干扰或可视化淀粉样蛋白自组装为AD和T2D中的治疗铅或非侵入性淀粉样蛋白诊断。
表征了促炎的非典型趋化因子MIF与其受体的相互作用,并设计了构象约束的肽,以干预这些相互作用,作为动脉粥样硬化的治疗铅。
Our research aims at understanding biomolecular interactions of proteins and polypeptides mediating biological and disease-associated processes via peptide chemistry and at developing novel molecules and tools to control or visualize these processes.
We are especially interested in understanding protein interactions mediating amyloid protein misfolding and related cell degeneration and in devising peptide-based molecules and chemical approaches to suppress these processes. We are also interested in characterizing proinflammatory chemokine interactions in atherosclerosis and in designing peptides to modulate these interactions and control their effects. We are using protein(peptide) chemical design and synthesis strategies and a broad range of biochemical and biophysical methods.
Current research activities aim at:
understanding protein misfolding and amyloid self-assembly underlying cell degeneration and pathogenesis of the protein aggregation diseases Alzheimer`s disease (AD) and type II diabetes (T2D).
devising peptide-based molecules to interfere with or visualize amyloid self-assembly as therapeutic leads or non-invasive amyloid diagnostics in AD and T2D.
characterizing interactions of the proinflammatory atypical chemokine MIF with its receptors and designing conformationally constrained peptides to intervene with these interactions as therapeutic leads for atherosclerosis.

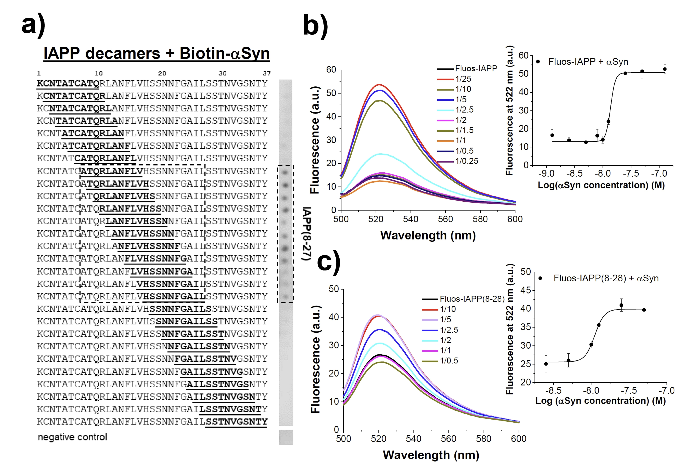
αSyn的淀粉样自组装与帕金森病(PD)的发病机制密切相关。αSyn在PD患者的大脑中形成神经毒性寡聚体和纤维,导致神经炎症和神经退行性变。
IAPP是2型糖尿病(T2D)中的关键淀粉样蛋白,其在胰腺中形成细胞毒性寡聚体和纤维,导致β细胞退化和T2D的发病。
研究表明,IAPP纤维可以加速αSyn的淀粉样自组装,且αSyn和IAPP在PD患者的大脑中共同聚集,提示这两种疾病之间可能存在分子联系。
研究团队设计合成了大环肽2b和2e,这些肽模拟了IAPP的自交叉作用位点,并能够抑制IAPP和阿尔茨海默病(AD)中的淀粉样β肽(Aβ40/42)的淀粉样自组装。

实验表明,2b和2e能够以纳摩尔级别的亲和力抑制αSyn的自组装和IAPP介导的交叉种子效应。
通过荧光光谱滴定和肽阵列分析,研究团队确定了αSyn的三个关键区域(αSyn(1–14)、αSyn(34–52)和αSyn(87–105))介导了其与MCTPs和IAPP的高亲和力相互作用。
2b 和 2e 能减轻 αSyn 寡聚体对小鼠海马突触长时程增强(LTP)的损伤,保护过表达 αSyn 的神经元,抑制 Aβ42 纤维对 αSyn 的交叉引发作用,且对胰岛素纤维化无抑制作用。
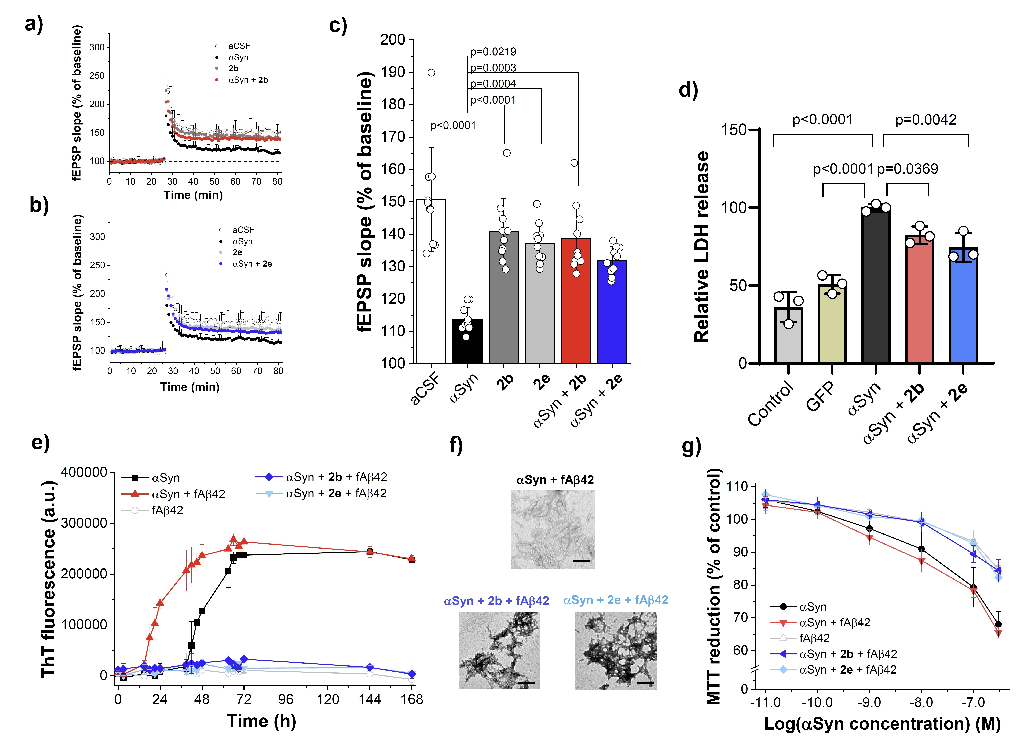
综上,2b 和 2e 是 αSyn 自聚集和 IAPP 交叉引发聚集的纳摩尔抑制剂,有望成为治疗 PD、T2D、AD 等疾病的多功能抗淀粉样药物先导。研究确定的 αSyn 关键片段,可作为设计新型多靶点抗淀粉样分子的有价值靶点。





