杭州专肽生物可将各种含有氨基或羟基的小分子化合物或药物分子,通过化学手段,与多肽的C端羧基,形成酰胺键或酯键,以合成种类繁多的多肽衍生物。以下展示部分常见的C端修饰种类。
| C端修饰种类 | 修饰简写 | 修饰结构 |
|---|---|---|
|
酰胺化 (Amidation) |
-NH2 | 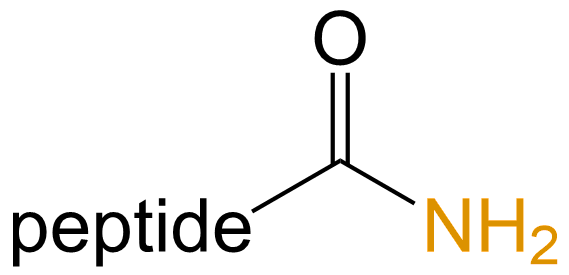 |
|
甲氨基化 (Methylation) |
-NHMe | 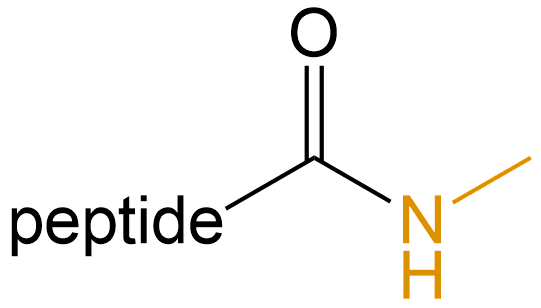 |
|
乙胺基化 (Ethamidation) |
-NHEt | 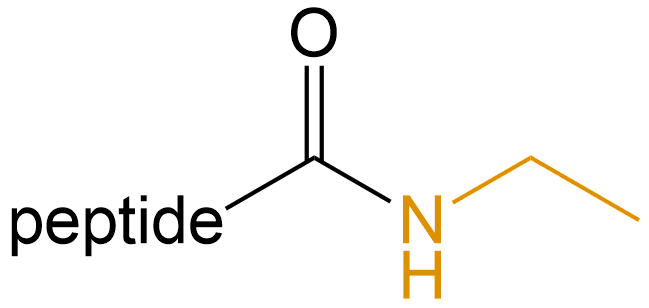 |
|
己氨基化 (Hexamidation) |
-NH(CH2)6 | 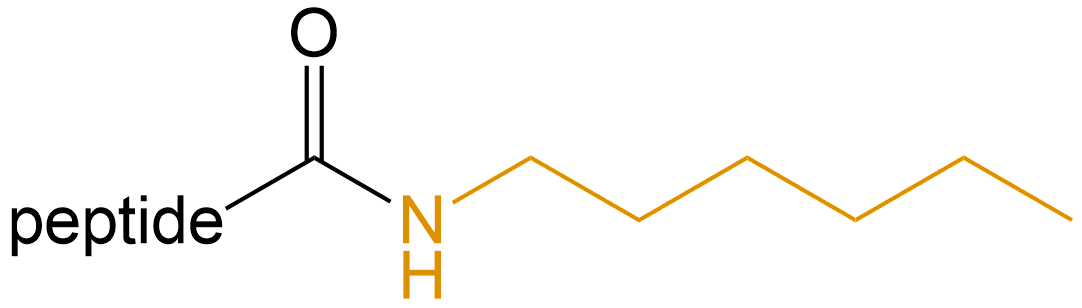 |
|
醇基化 (Alcoholylation) |
-OL | 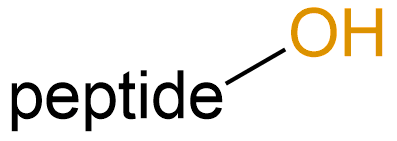 |
|
甲酯化 (Methylation) |
-OMe | 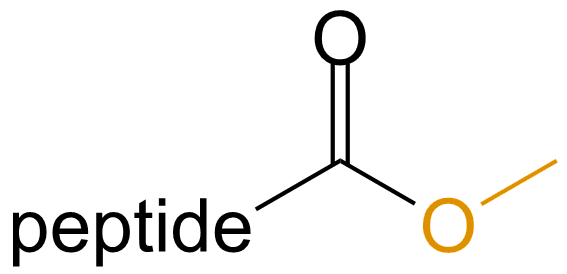 |
|
乙酯化 (Ethylation) |
-OEt | 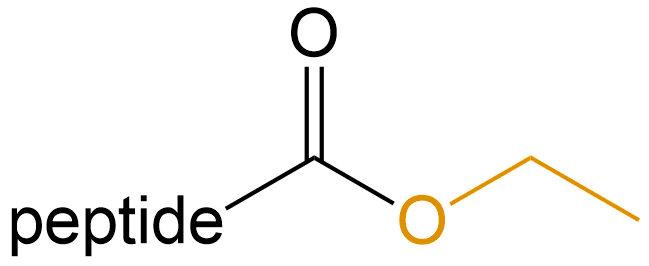 |
|
苄酯化 (Benzyl esterification) |
-OBzl | 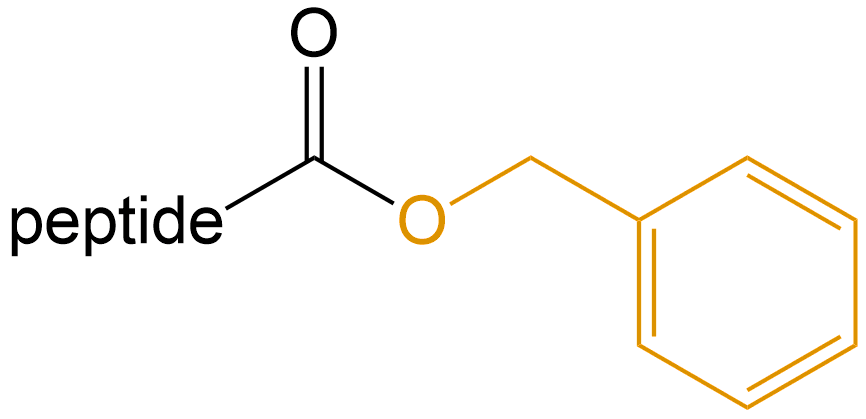 |
|
醛基化 (Aldolization) |
-CHO | 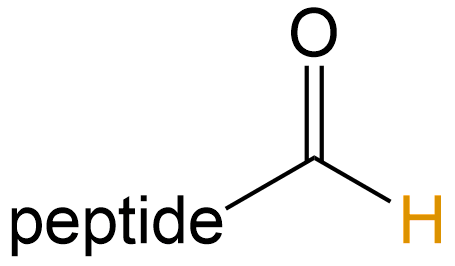 |
|
对硝基苯胺 (P-nitroaniline) |
-pNA | 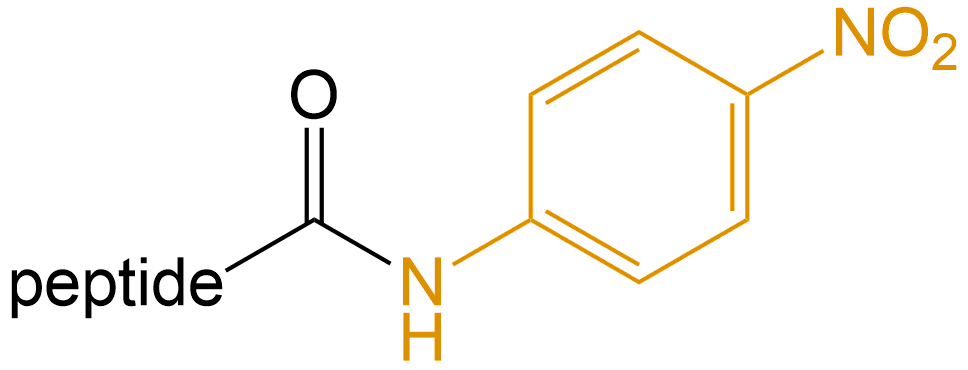 |
|
7-氨基-4-三氟甲基香豆素 (7-amino-4-trifluoromethylcoumarin) |
-AFC | 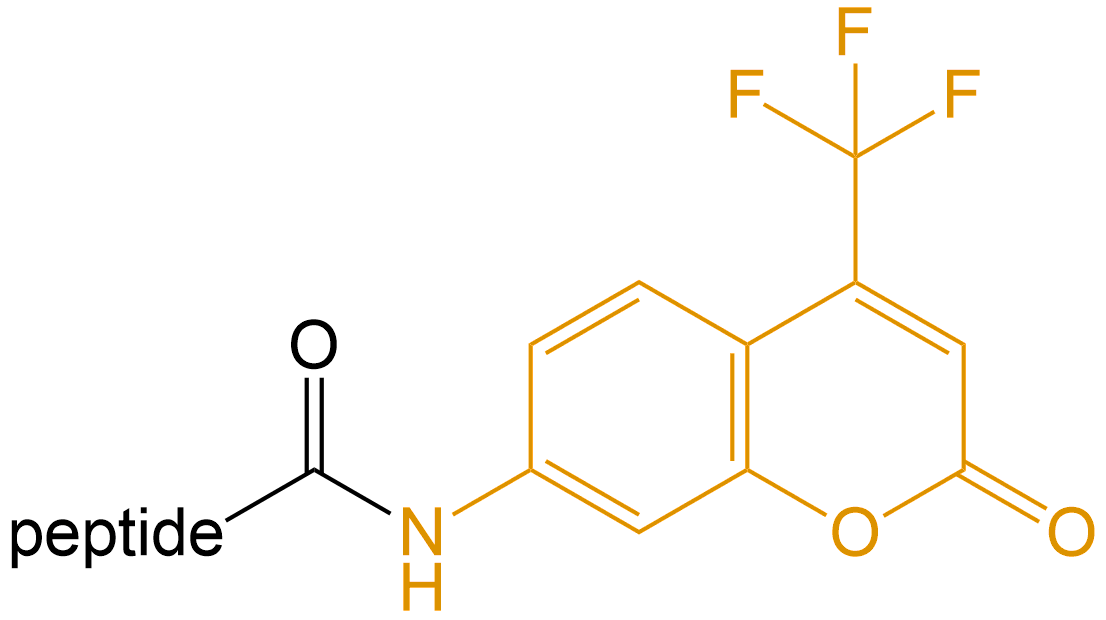 |
|
7-氨基-4-甲基香豆素 (7-amino-4-methylcoumarin) |
-AMC |  |
|
氯甲基酮 (Chloromethyl ketone) |
-CMK | 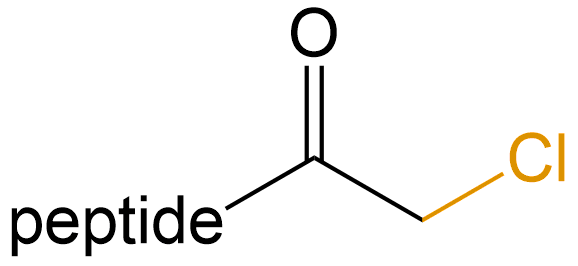 |
|
氟甲基酮 (Fluoromethyl ketone) |
-FMC | 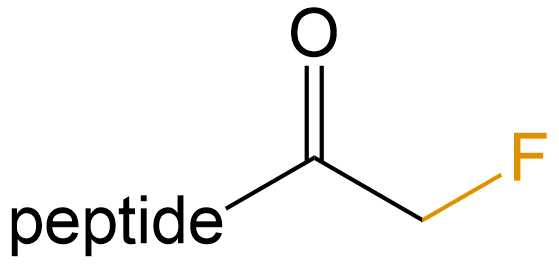 |
|
2,6-二甲苯甲酰氧甲基酮 (2,6-xylyloxymethyl ketone) |
-AOMK | 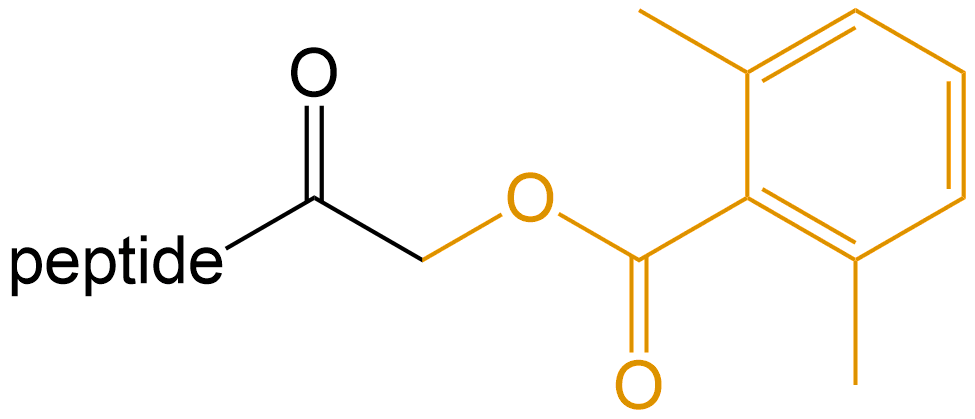 |
|
多巴胺 (Dopamine) |
-DOPA | 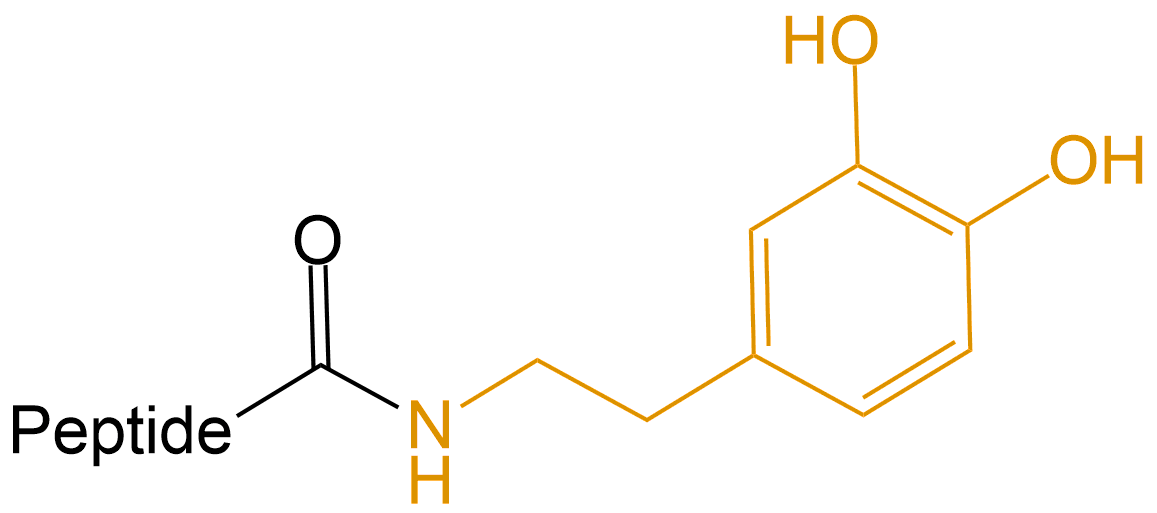 |
|
苯胺 (Phenylamine) |
-NHPh | 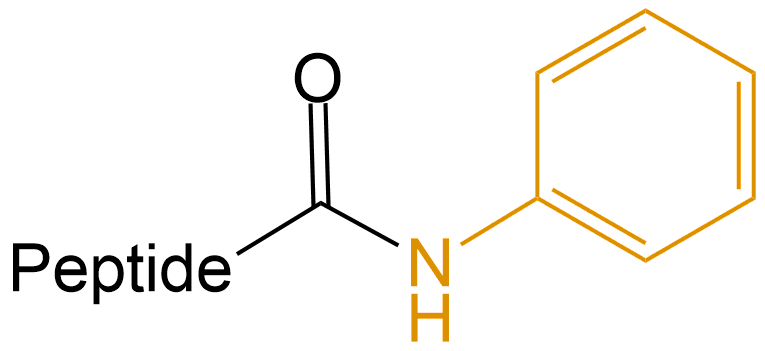 |
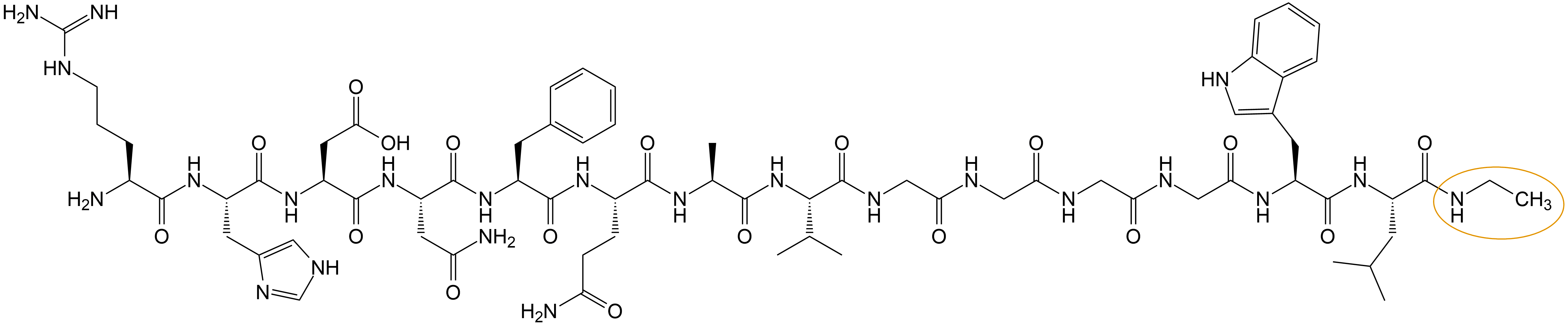
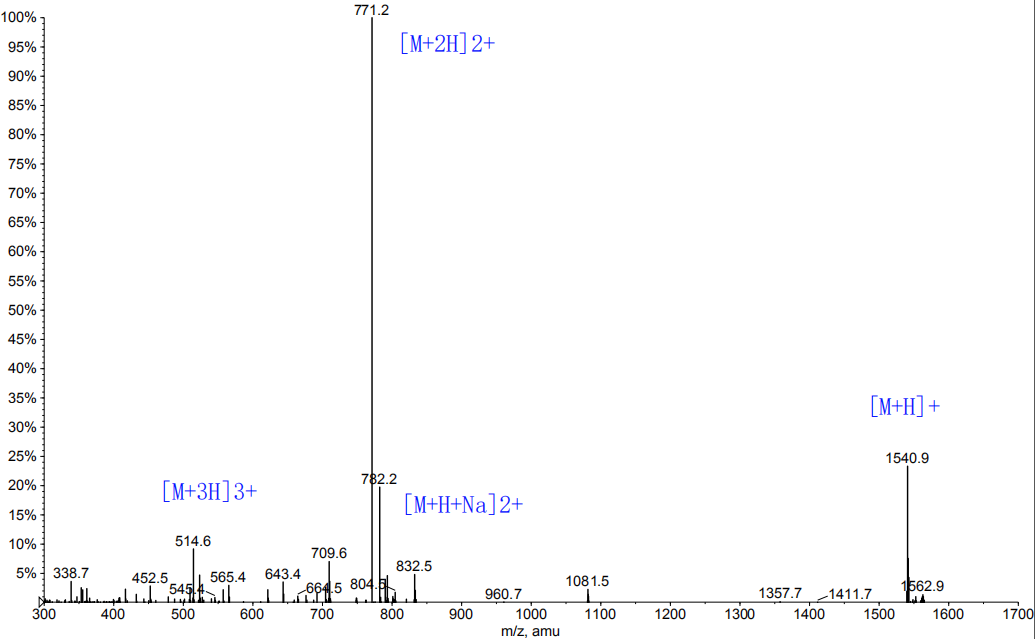
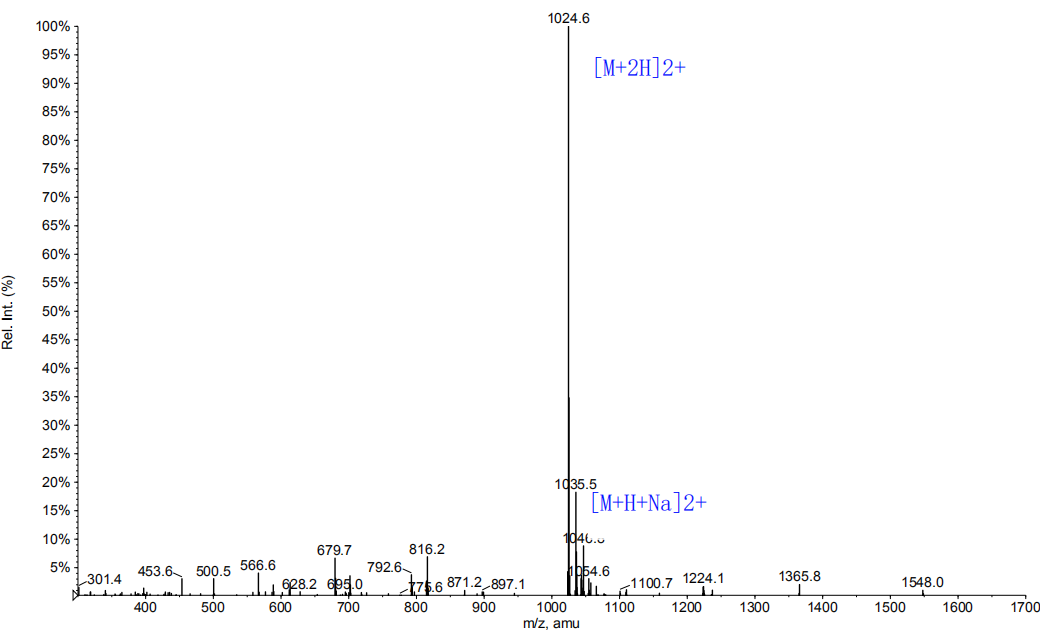
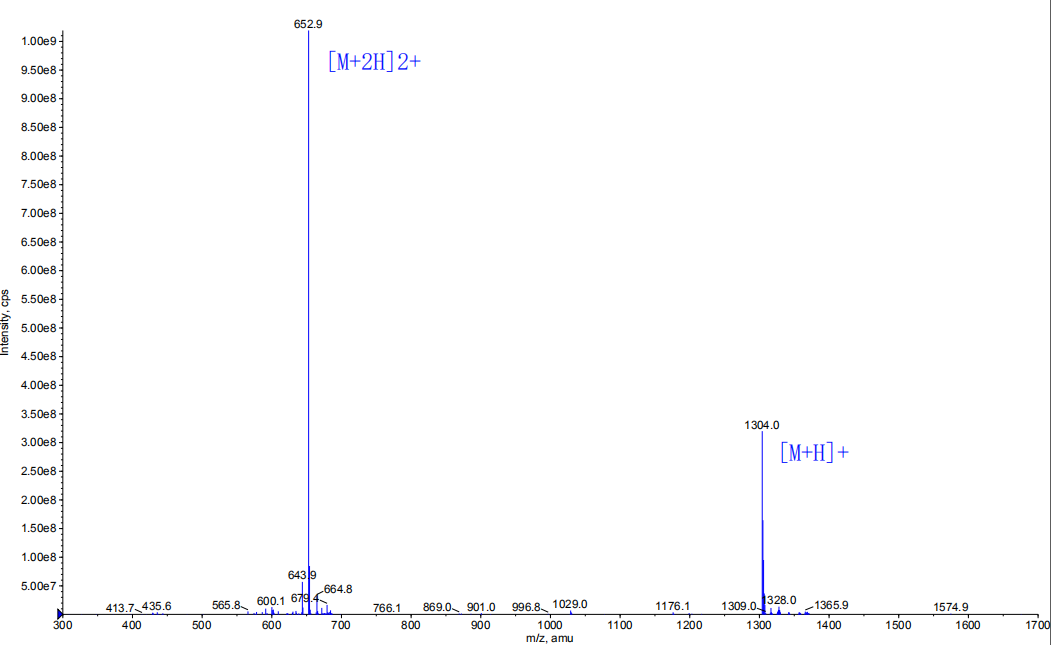
1, 产品序列:H-Arg-His-Asp-Asn-Phe-Gln-Ala-Val-Gly-Gly-Gly-Gly-Trp-Leu-NHCH2CH3
2, 产品结构:
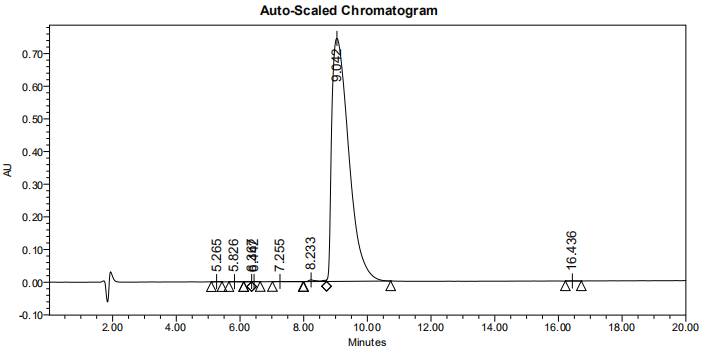
3,产品HPLC图谱
4,产品MS图谱
| 修饰名称 | 修饰简写 | 修饰结构 |
|---|---|---|
|
生物素化 (Biotinylation) |
Biotin- | 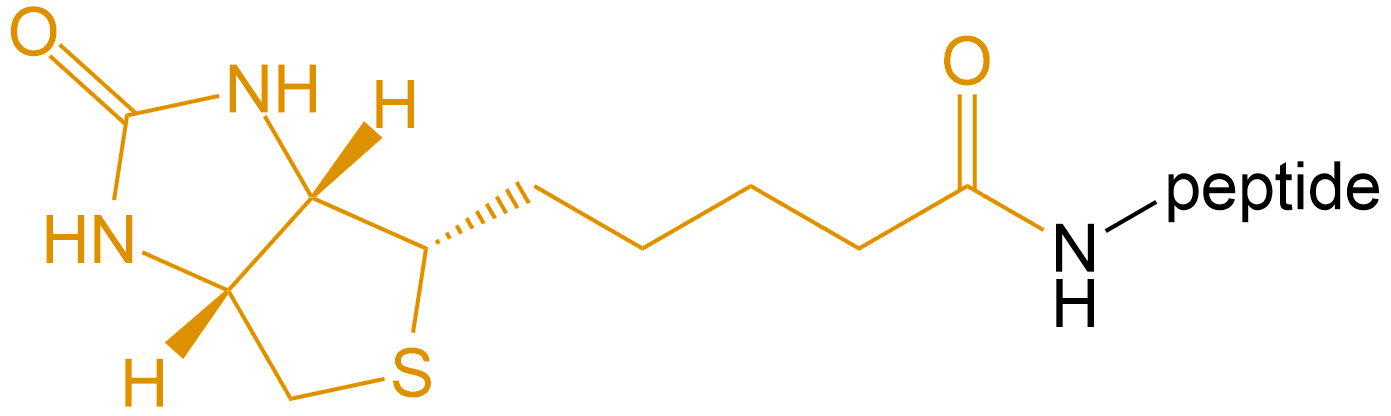 |
|
生物素-6氨基己酸 (Biotin-Acp-) |
Biotin-Acp- | 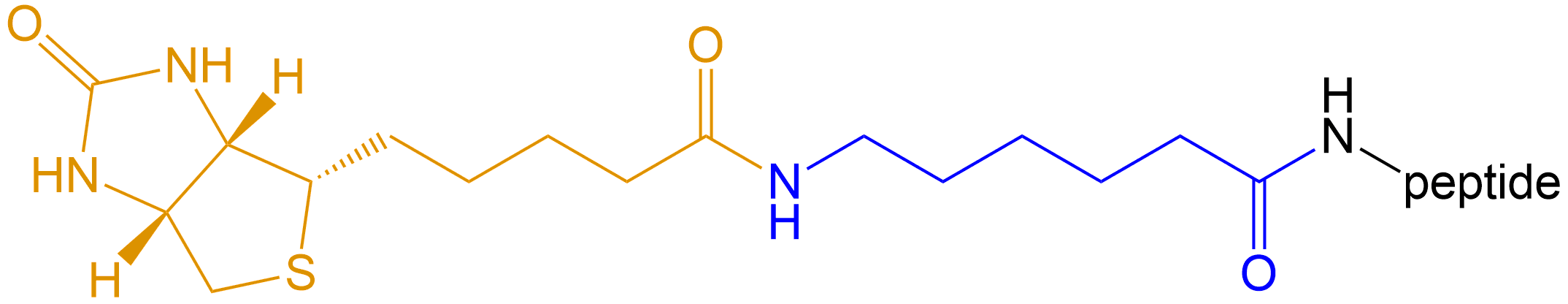 |
|
2-叠氮乙酸 (2-azidoacetic Acid) |
N3-Gly- | 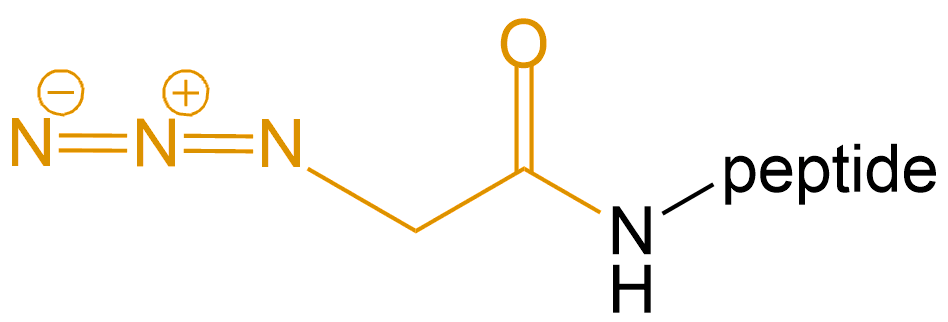 |
|
5-叠氮戊酸 (5-Azivalic Acid) |
N3-Ava- |  |
|
6-叠氮己酸 (6-azidohexanoic Acid) |
N3-Acp- |  |
|
3-马来酰亚氨基丙酸 (3-Maleimidopropionic Acid) |
MIPA- |  |
|
6-马来酰亚胺基己酸 (6-Maleimidocaproic Acid) |
Mal- | 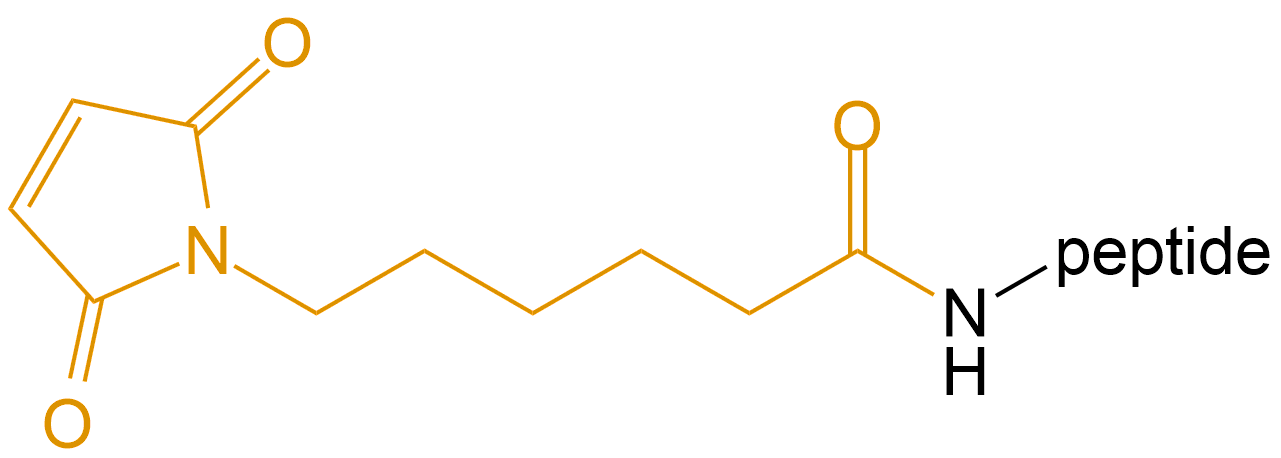 |
|
丁酸 (Butyric Acid) |
But- | 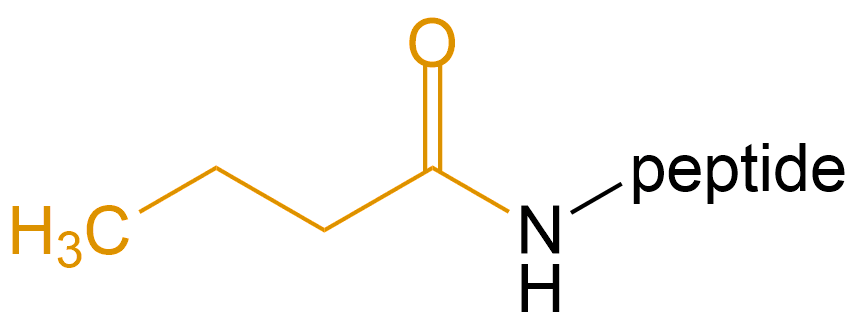 |
|
丁二酸/琥珀酸 (Succinic Acid) |
Suc- | 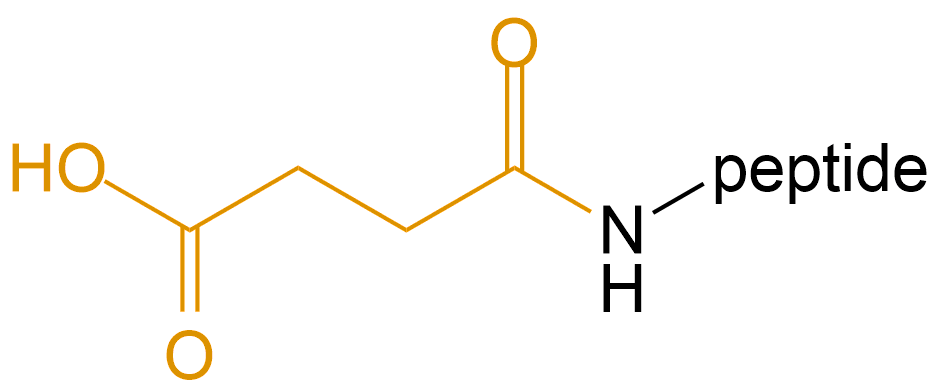 |
|
异丁酸 (Isobutyric Acid) |
Iba | 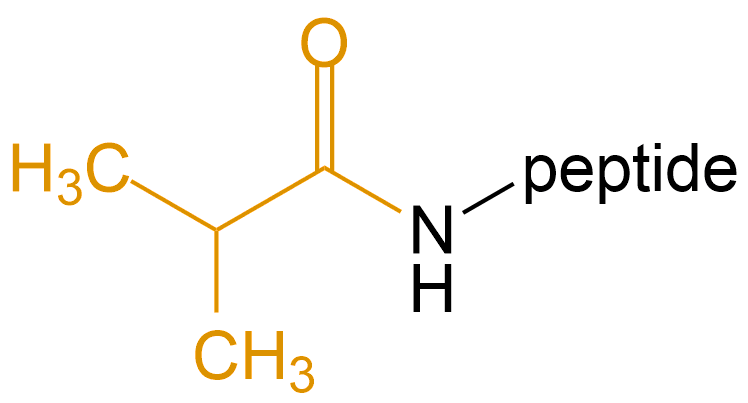 |
|
N-炔丙基甘氨酸 (N-Propargylglycine) |
N-Propargylglycine- | 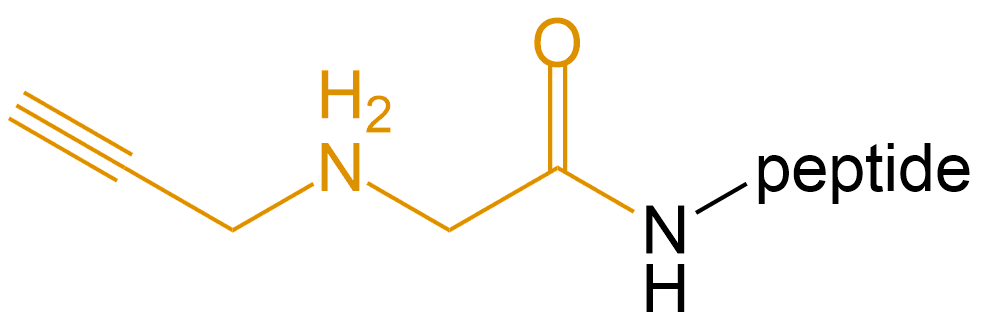 |
|
硫辛酸 (Lipoic Acid) |
lipoic acid- | 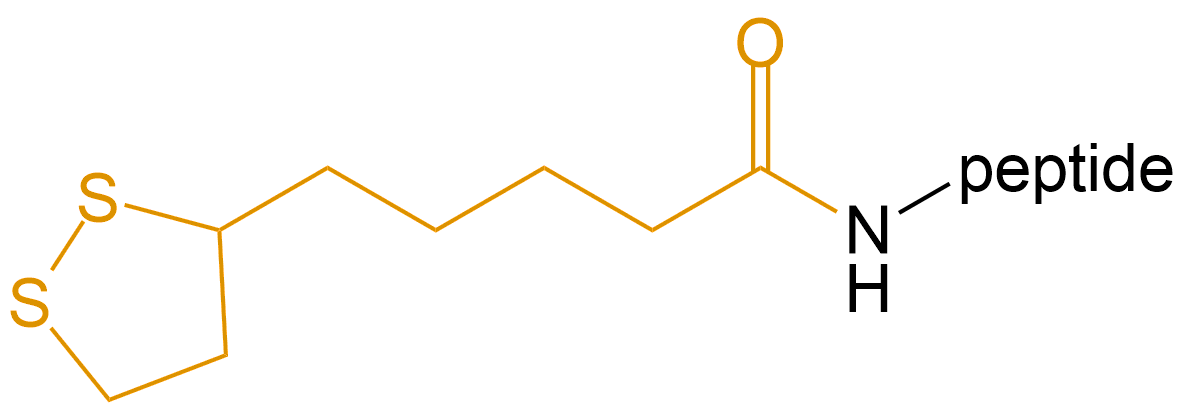 |
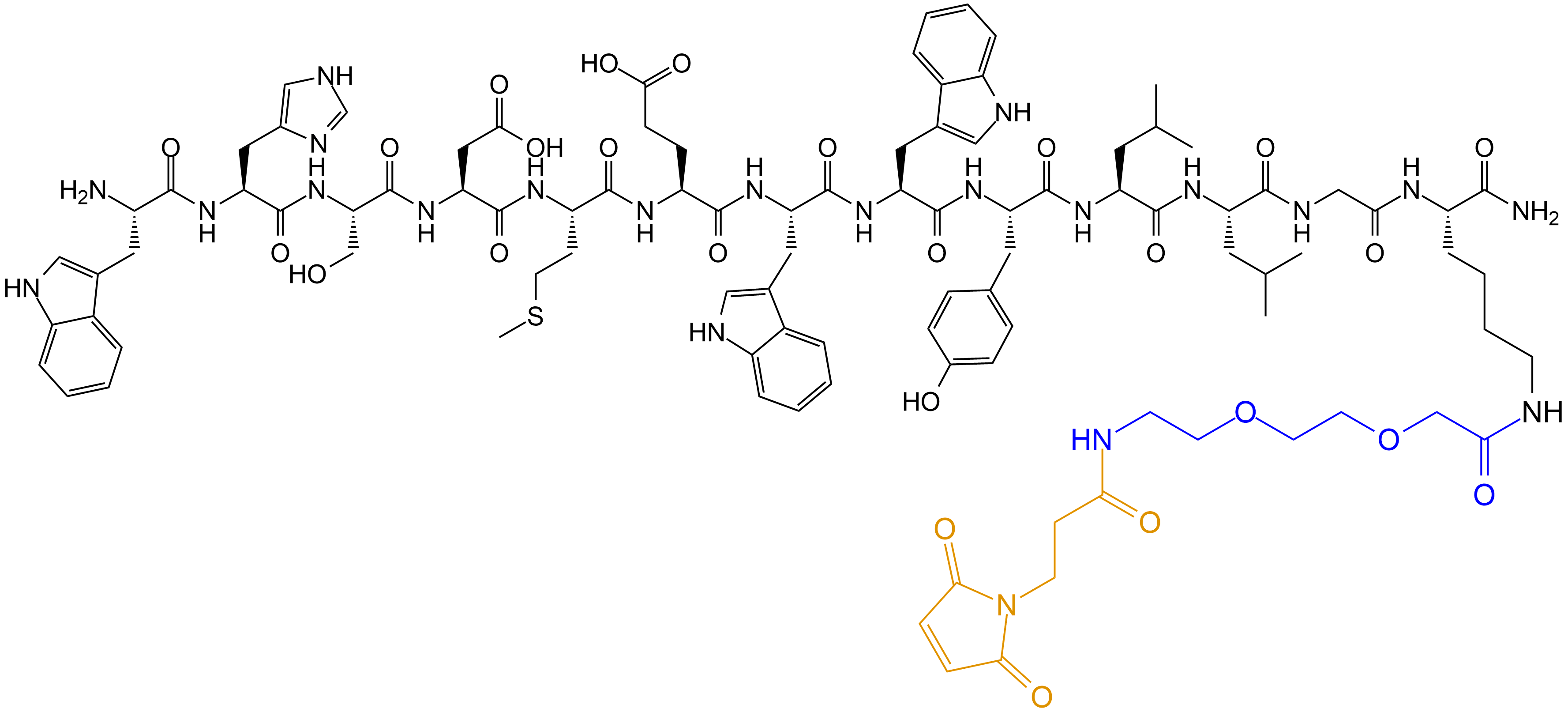
1、产品序列:H2N-WHSDMEWWYLLGK(AEEA-MIPA)-OH,MIPA: 3-马来酰亚氨基丙酸,AEEA: NH2-PEG2-乙酸
产品结构:
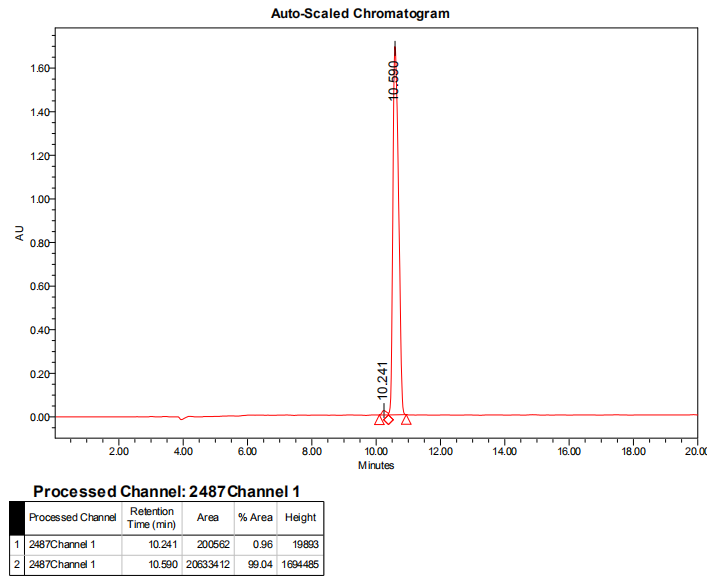
2、HPLC图:
3、MS图:
多肽荧光标记由于没有放射性,实验操作简单。因此,目前在生物学研究中多肽荧光标记应用非常广泛,多肽荧光标记方法与荧光试剂的结构有关系,对于有游离羧基的采用的方法与接多肽反应相同,也采用HBTU/HOBt/DIEA方法连接。 在N端标记FITC的多肽需经历环化作用来形成荧光素,通常会伴有最后一个氨基酸的去除,但当有一个间隔器如氨基己酸,或者是通过非酸性环境将目的多肽从树脂上切下来时,这种情况可避免在切割的过程中被TFA切割掉。
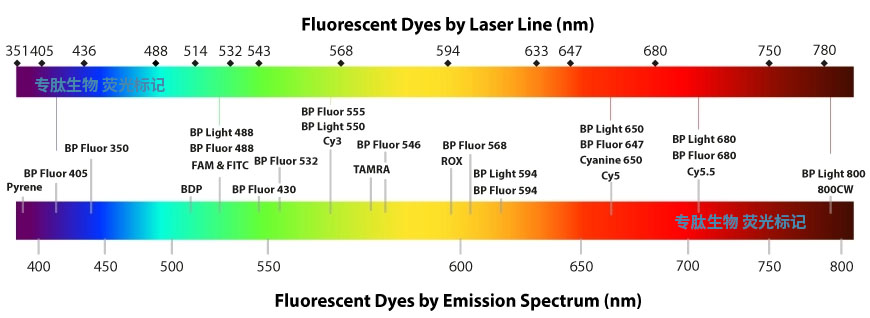
(红色加粗的荧光基团,为常用基团)
| 荧光标记分类 | 标记基团 | 入射波长 | 发射波长 | 标记位置 | 结构 |
|
Alexa Fluor系列
|
Alexa Fluor 350
|
346
|
445 |
肽链 N 端、Lys 侧链和 Cys 侧链
|
|
|
Alexa Fluor 405
|
400
|
424
|
肽链 N 端、Lys 侧链和 Cys 侧链
|
||
|
Alexa Fluor 430
|
430
|
545
|
肽链 N 端、Lys 侧链和 Cys 侧链
|
||
|
Alexa Fluor 488
|
494
|
517
|
肽链 N 端、Lys 侧链和 Cys 侧链
|
||
|
Alexa Fluor 514
|
517
|
542
|
肽链 N 端、Lys 侧链和 Cys 侧链
|
||
|
Alexa Fluor 532
|
530
|
555
|
肽链 N 端、Lys 侧链和 Cys 侧链
|
||
|
Alexa Fluor 594
|
590
|
617
|
肽链 N 端、Lys 侧链和 Cys 侧链
|
||
| Alexa Fluor 647 | 650 | 668 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
Bodipy系列
|
Bodipy 493/503
|
500 | 506 | 肽链 N 端、Lys 侧链和 Cys 侧链 | |
|
Bodipy FL
|
503 | 509 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
Bodipy R6G
|
528 | 550 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
Bodipy 530/550
|
534 | 554 | 肽链 N 端、Lys 侧链 | ||
|
Bodipy TMR-X
|
542 | 574 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
Bodipy 558/568
|
558 | 569 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
Bodipy 576/589
|
576 | 590 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
Bodipy 581/591
|
584 | 592 | 肽链 N 端、Lys 侧链 | ||
|
Bodipy TR
|
589 | 617 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
Bodipy 630/650
|
625 | 640 | 肽链 N 端、Lys 侧链 | ||
|
Cy系列荧
|
Cy-3 | 550 | 570 | 肽链 N 端、Lys 侧链和 Cys 侧链 | |
| Cy-5 | 646 | 662 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
| Cy-5.5 | 673 | 707 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
| Cy-7 | 750 | 773 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
Fluorescein系列荧
|
FITC | 492 | 518 | 肽链 N 端、Lys 侧链和 Cys 侧链 | |
| FAM | 494 | 522 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
QSY系列
|
QSY-7
|
560 | None | 肽链 N 端、Lys 侧链和 Cys 侧链 | |
|
QSY-9
|
562 | None | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
QSY-21
|
661 | None | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
Rhodamine系列
|
Texas Red
|
595 | 615 | 肽链 N 端、Lys 侧链和 Cys 侧链 | |
|
RF488
|
498 | 520 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
TAMRA
|
565 | 580 | 肽链 N 端、Lys 侧链和 Cys 侧链 | ||
|
Rhodamine B
|
555 | 580 | 肽链 N 端、Lys 侧链 | ||
|
Rhodamine Red-X
|
570 | 590 | 肽链 N 端、Lys 侧链 | ||
|
其它荧光标记
|
Dansyl
|
333 | 518 | 肽链 N 端、Lys 侧链 | |
|
Dabcyl
|
454
|
None | 肽链 N 端、Lys 侧链 | ||
|
DNP
|
350 | None | 肽链 N 端、Lys 侧链 | ||
|
MCA
|
358 | 410 | 肽链 N 端、Lys 侧链 | ||
|
SBF
|
385 and 515
|
None | Cys 侧链 | ||
|
EDANS
|
335 | 493 |
Glu 或 Asp 侧链
|
||
|
7-OHCCA
|
342(pH=4)
|
447(pH=4)
|
肽链 N 端和 Lys 侧链
|
||
|
Dacia
|
376 | 465 | Cys 侧链 | ||
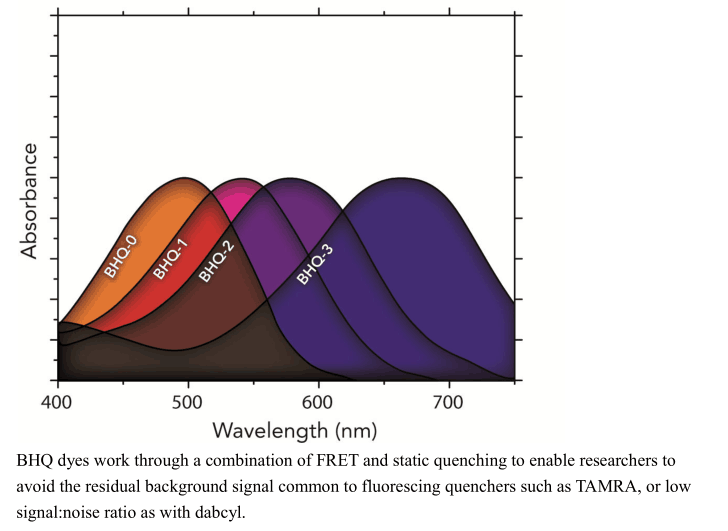
| BHQ-1 | 480 | 580 | 肽链 N 端、Lys 侧链 | ||
| BHQ-2 | 560 | 670 | 肽链 N 端、Lys 侧链 | ||
| BHQ-3 | 620 | 730 | 肽链 N 端、Lys 侧链 | ||
| JOE | 520 | 548 | 肽链 N 端、Lys 侧链 |
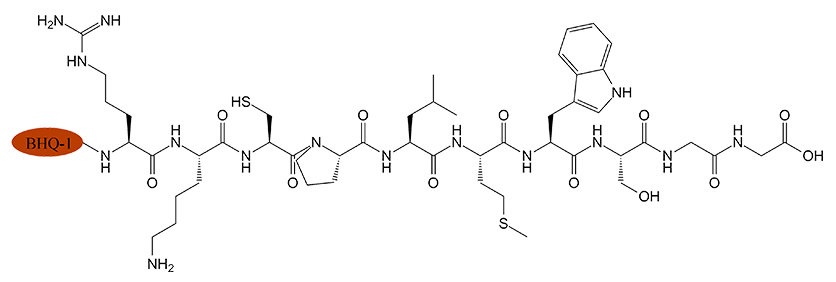
1、产品序列:BHQ-1-Arg-Lys-Cys-Pro-Leu-Met-Trp-Ser-Gly-Gly-OH
2、产品结构:
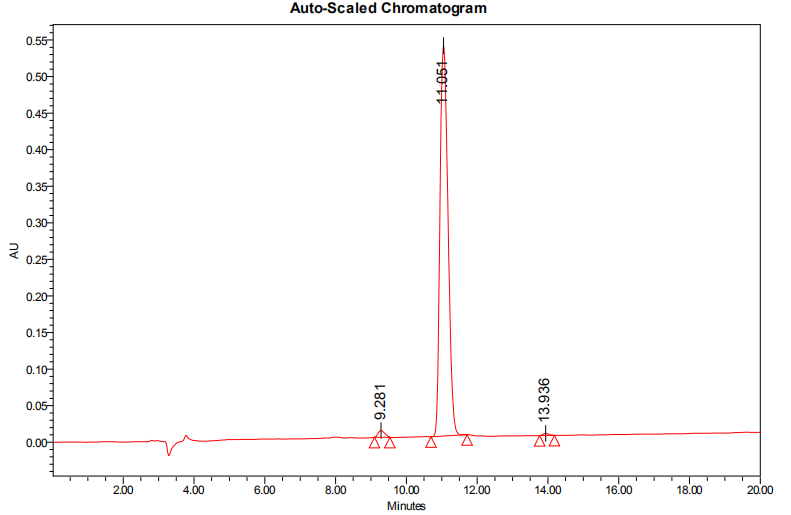
3、产品HPLC报告:
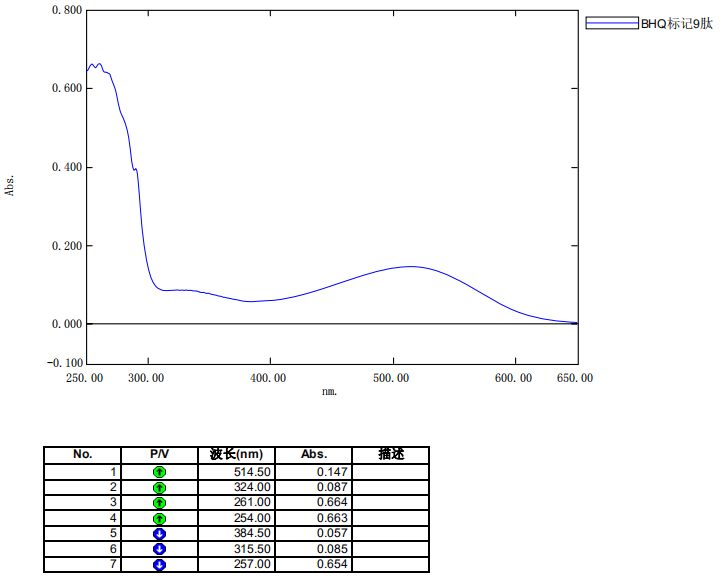
4、产品紫外检测报告:
| 修饰简写 | 修饰结构 |
|---|---|
| Abz和pNA |  |
| DABCYL和EDANS |  |
| Dansyl和EDANS | 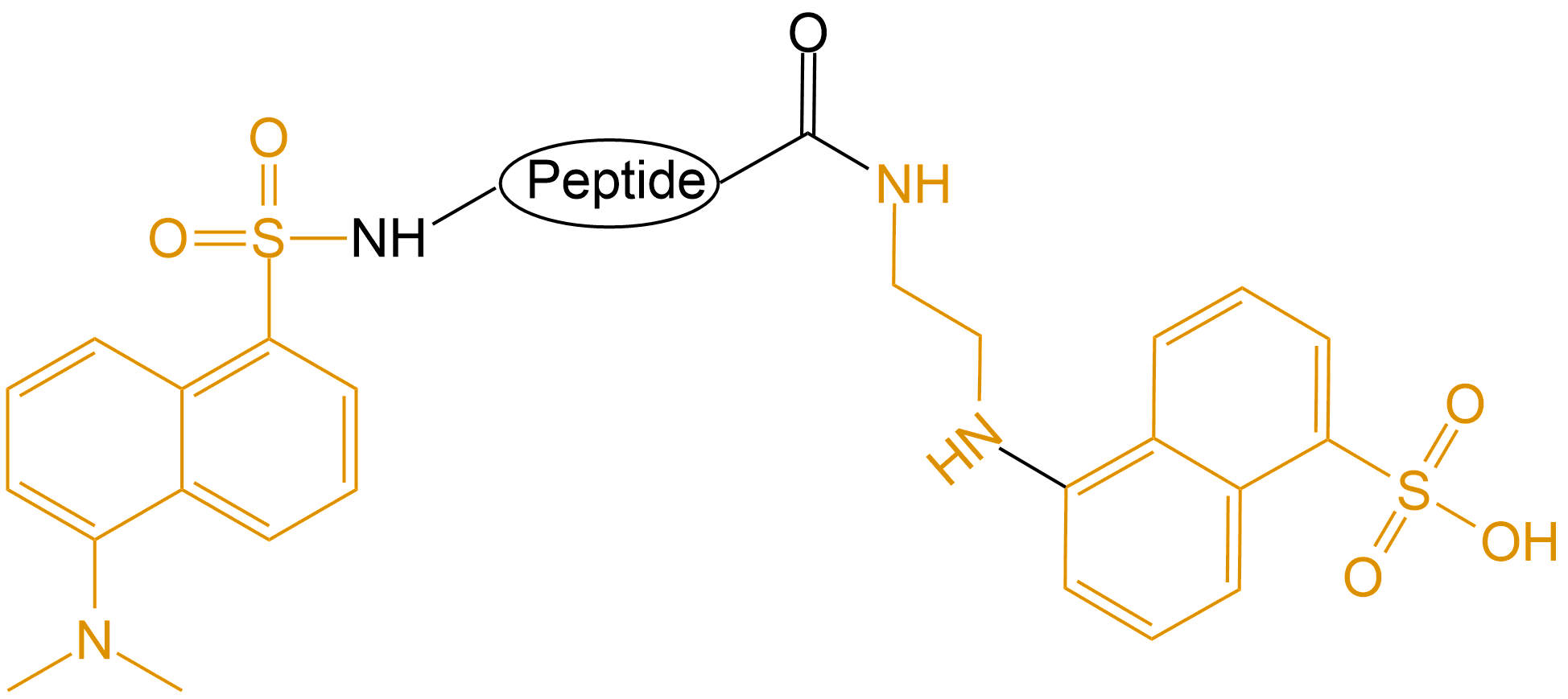 |
| Suc和AMC | 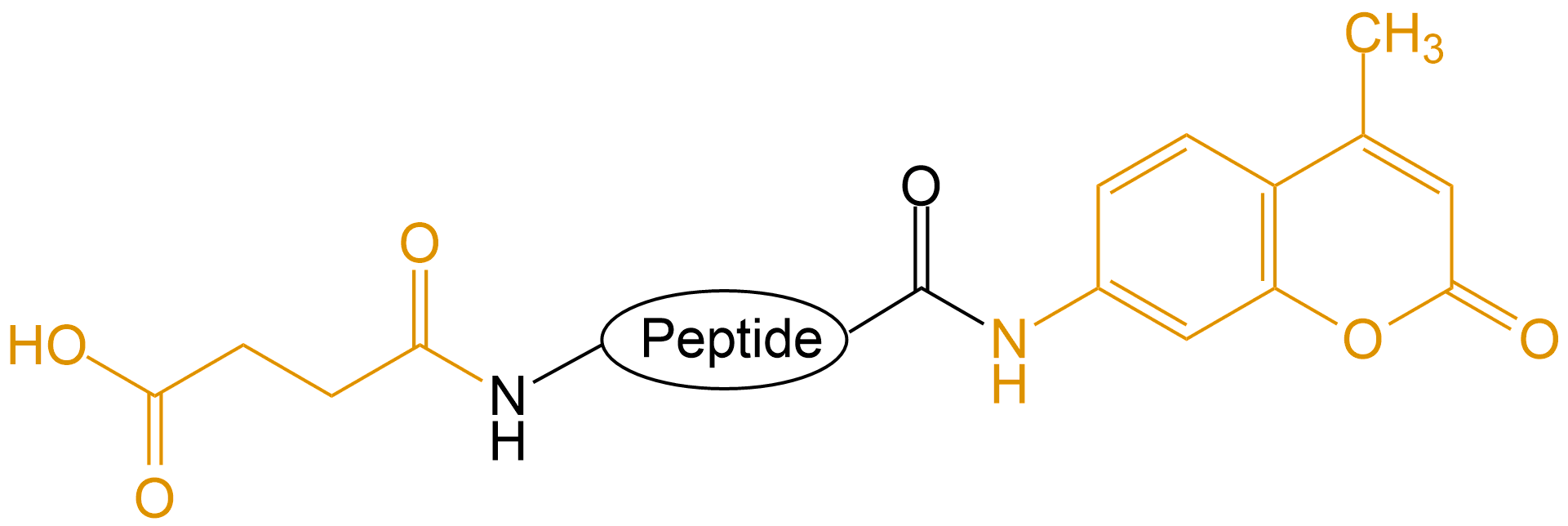 |
1,产品序列:(Abz)-VAGL-pNA
2,产品结构:
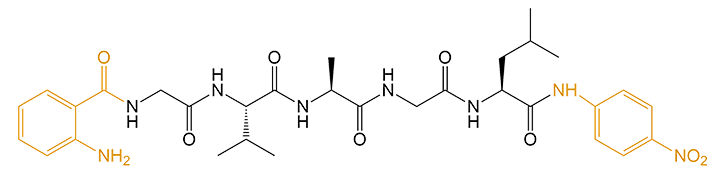
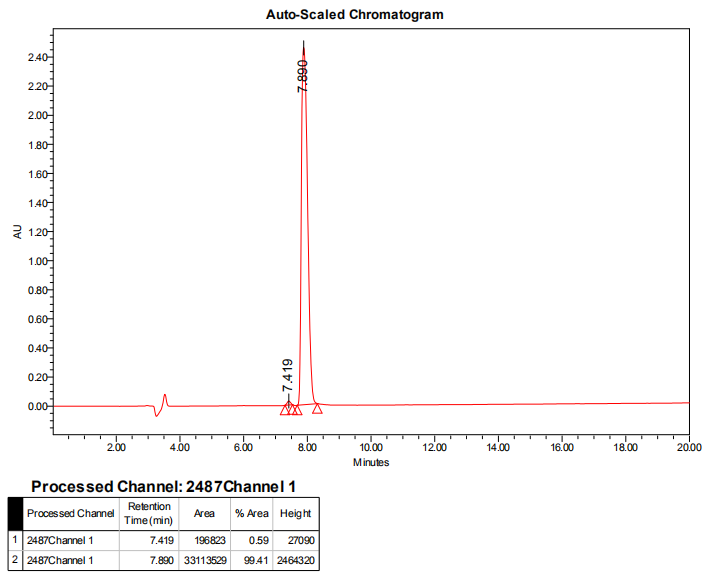
3,产品HPLC报告:
4,产品MS报告:

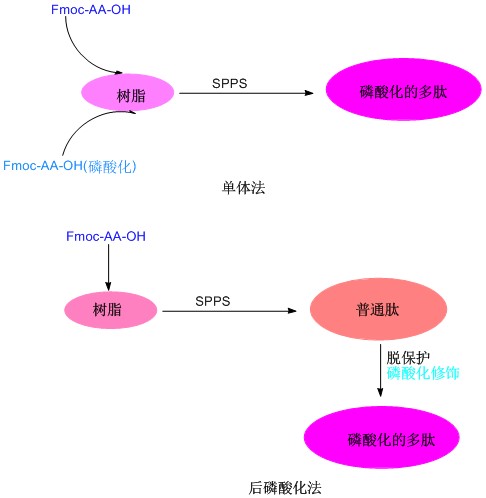
1、磷酸化应用:磷酸肽在生命过程中发挥重要作用,磷酸化的位置在多肽上的Tyr、Ser,Thr,。目前磷酸肽合成一般都采用磷酸化氨基酸,目前使用的都是单苄基磷酸化氨基酸。磷酸化氨基酸的连接一般采用HBTU/HOBt/DIEA方法,但是目前采用该方法合成磷酸化多肽也有缺点,特别是在合成多磷酸化多肽或氨基酸较长的多肽的时候,连接效率低,最后产品纯度很低,对于这种磷酸化多肽,我们考虑采用后磷酸化方法,其合成过程就是在多肽合成结束后,选择性脱去要标记的氨基酸的侧链保护基,对于Tyr,Thr可以直接使用侧链不保护的氨基酸进行反应,而Ser可以采用Fmoc-Ser(trt),在1% TFA/DCM条件下可以定量的脱除。后磷酸化,采用双苄基亚磷酰胺,四氮唑生成亚磷酰胺四唑活性中间体,连接到羟基上,随后在过氧酸下氧化生成磷酰基,完成反应。
2、磷酸化修饰分类
2.1. L型磷酸化修饰
Thr(H2PO3)、 pT 、苏氨酸磷酸化
Tyr(H2PO3)、pY 、酪氨酸磷酸化
Ser(H2PO3) 、pS、丝氨酸磷酸化
2.2. D型磷酸化修饰
D-Thr(H2PO3)、p(D-T) 、D型苏氨酸磷酸化
D-Tyr(H2PO3)、p(D-Y) 、D型酪氨酸磷酸化
D-Ser(H2PO3) 、p(D-S)、D型丝氨酸磷酸化
2.3. 双磷酸化修饰
一个序列中有两个Thr,Tyr,Ser 位点进行磷酸化修饰。
2.4. 多磷酸化修饰
一个序列中有多个Thr,Tyr,Ser 位点进行磷酸化修饰
3、磷酸化位点结构
| 修饰名称 | 修饰简写 | 修饰结构 |
|---|---|---|
| 磷酸化丝氨酸 | pSer、Ser(H2PO3) | 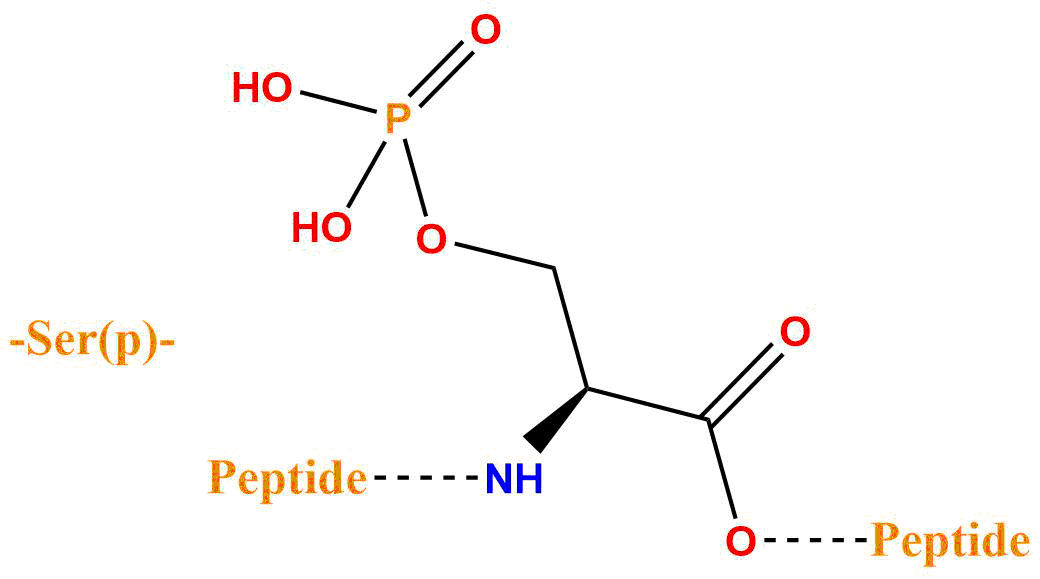 |
| 磷酸化酪氨酸 | pTyr、Tyr(H2PO3) | 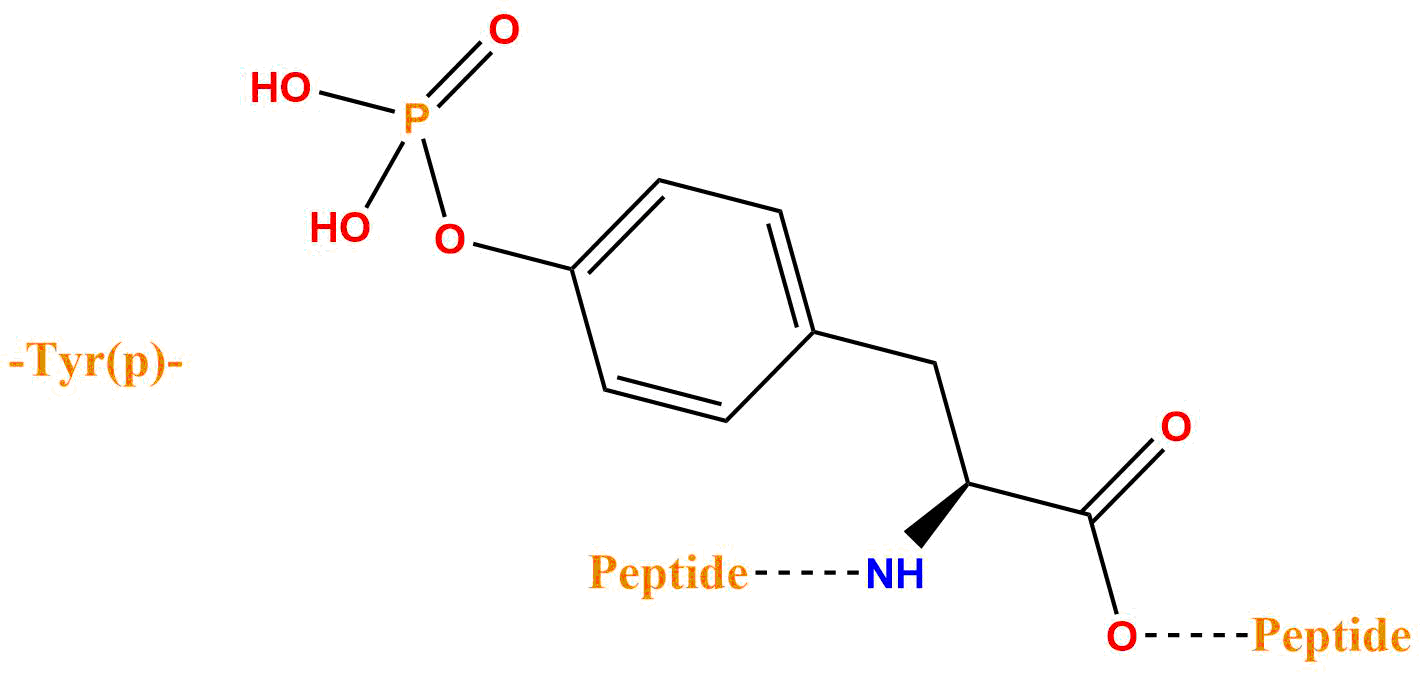 |
| 磷酸化苏氨酸 | pThr、Thr(H2PO3) | 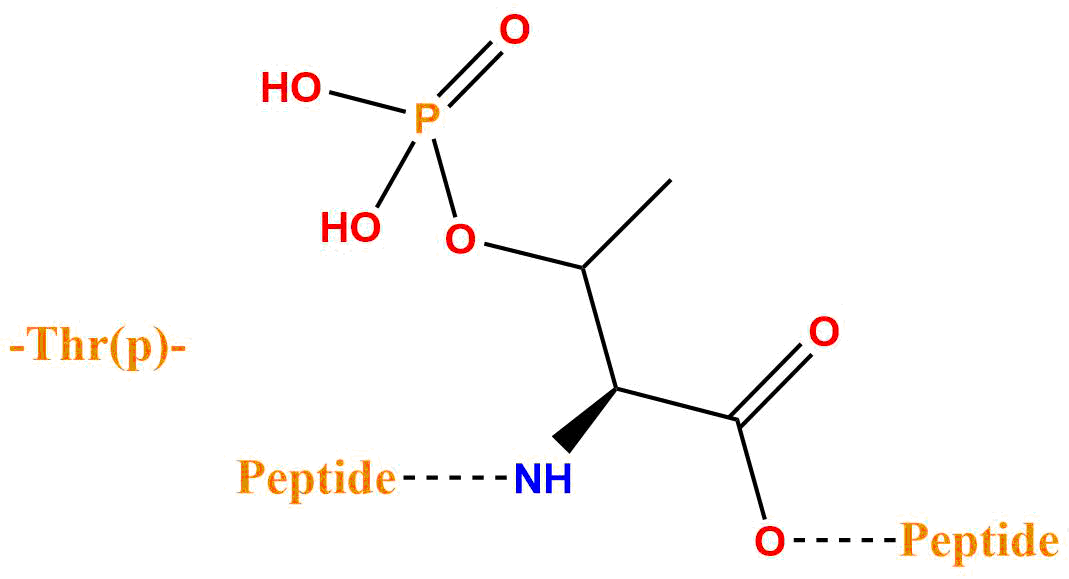 |
4 、磷酸化的作用
蛋白质磷酸化是生物界最普遍,也是最重要的一种蛋白质翻译后修饰,20世纪50年代以来一直被生物学家看作是一种动态的生物调节过程。在细胞中,大概有1/3的的蛋白质被认为是通过磷酸化修饰的。蛋白质的磷酸化修饰与多种生物学过程密切相关,如DNA损伤修复、转录调节、信号传导、细胞凋亡的调节等。磷酸化蛋白质及多肽的研究可以帮助人们阐述上述过程的机理,进一步认识生命活动的本质。近年来随着蛋白质组技术的不断发展,蛋白质磷酸化的研究越来越受到广泛的关注。
蛋白质磷酸化在细胞信号转导中的作用
磷酸化多肽主要指肽链中的Ser、Tyr和Thr残基的侧链羟基被修饰成酸式磷酸酯多肽。磷酸化多肽是研究蛋白质磷酸化过程的必不可少的工具,因此研究蛋白质及多肽的磷酸化反应并确定成熟简便的合成路线就变得非常重要。目前为止,多肽的磷酸化修饰主要有后磷酸化法和单体法两种合成方法。后磷酸化法是多肽序列在树脂上合成完后,再对其中的Ser、Tyr或Thr的侧链羟基进行磷酸化;单体法则是将适当保护的磷酸化氨基酸直接引入到多肽序列中,这种方法较后磷酸化法操作更为简便,已经成为多肽磷酸化修饰的主要方法。单体法修饰时,磷酸化的氨基酸由于侧链修饰的较大基团产生的位阻而导致难以与肽链缩合,并且之后的氨基酸引入都会比较困难,尤其在含有多个磷酸化位点修饰时,合成将变得异常困难,并且最终产物成分复杂,难以分离,产率极低。因此,当肽链中多个位点进行磷酸化时,可以考虑采用后磷酸化法,其合成过程主要就是在多肽合成结束之后,选择性的脱去要标记氨基酸的侧链保护基,对于Tyr,Thr可以直接使用侧链不保护的氨基酸进行反应。侧链保护基在1% TFA/DCM条件下可以定量的脱除。后磷酸化时,可以采用双苄基亚磷酰胺,四氮唑生成亚磷酰胺四唑活性中间体,连接到羟基上,然后在过氧酸条件下氧化生成磷酰基,完成反应。
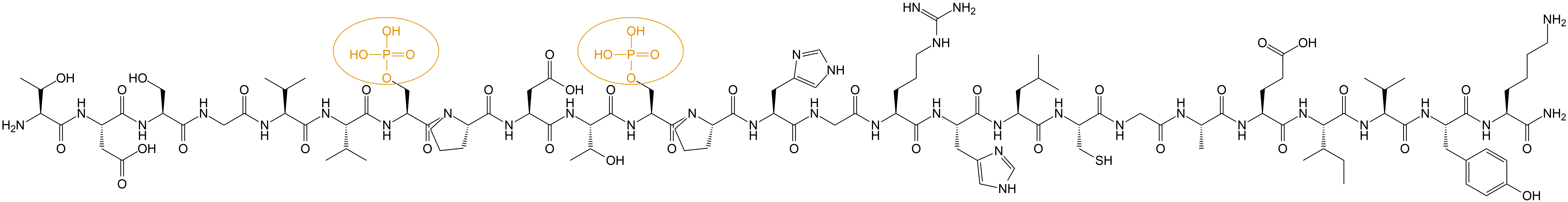
1、多肽序列:TDHGAEIVYK (pSer)PVVSGDT(pSer)P RHL –CONH2
2、多肽结构:
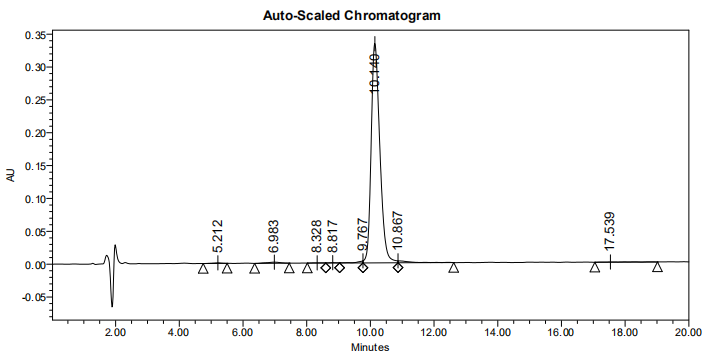
3、HPLC图谱:
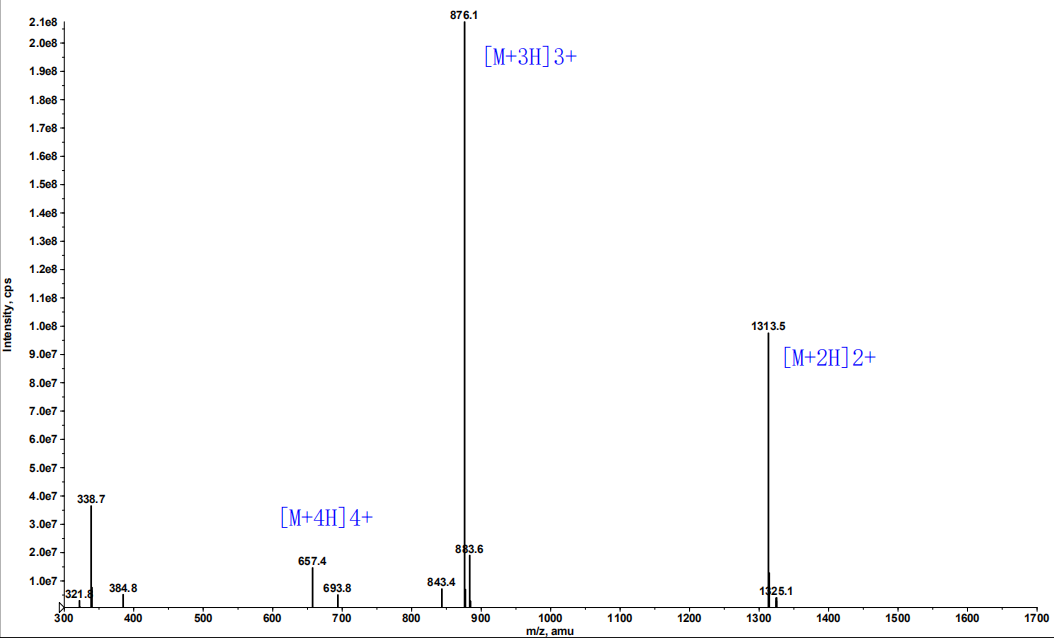
与自然界中普遍存在的20种L型氨基酸相比,19种D型氨基酸(Gly没有手性)往往在多肽活性和稳定性中有着特殊作用,因此常被做为最基本的序列改造工具。
D型氨基酸可用于酶的结构-功能分析方面的研究;用于合成多肽药物,如多肽抗生素(阿扑西林ASPOXICILLIN),肠胃药(OXTREOTIDE),利尿药,腹泻药(善得定SANDOSTATIN ACETATE),酶抑制剂,促皮质素类似物,止痛镇痛药,减肥药,Ⅱ型糖尿病治疗药(那格列奈NATEGLINIDE)等。
在专肽生物的多肽合成服务中,我们专门列了这样一个19种D型氨基酸栏目,方便大家去选择。
{D-Ala} D-丙氨酸
{D-Arg} D-精氨酸
{D-Asp} D-天冬氨酸
{D-Asn} D-谷氨酰胺
{D-Cys} D-半胱氨酸
{D-Glu} D-谷氨酸
{D-Gln} D-谷氨酰胺
{D-His} D-组氨酸
{D-Allo-Ile} D-别异亮氨酸
{D-Leu} D-亮氨酸
{D-Lys} D-赖氨酸
{D-Met} D-甲硫氨酸
{D-Pro} D-脯氨酸
{D-Phe} D-苯丙氨酸
{D-Ser} D-丝氨酸
{D-Tyr} D-酪氨酸
{D-Thr} D-苏氨酸
{D-Trp} D-色氨酸
{D-Val} D-缬氨酸
注:Gly甘氨酸没有手性, Ile对应的为D-别异亮氨酸。
1、产品序列:全D型nghqtpalqqgthssrqvtplslrsrsstfnk
2、产品结构:
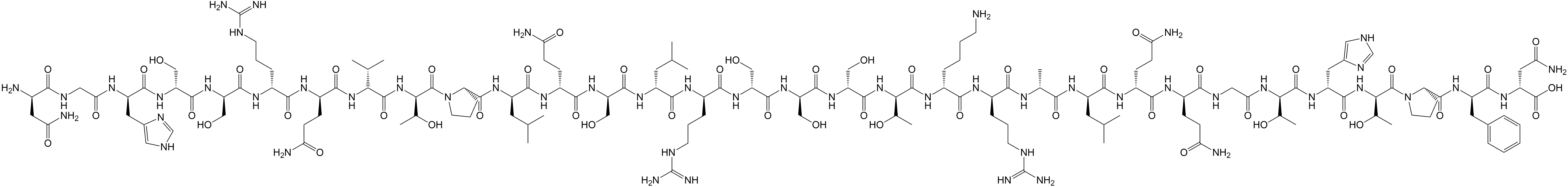
3、产品HPLC报告:
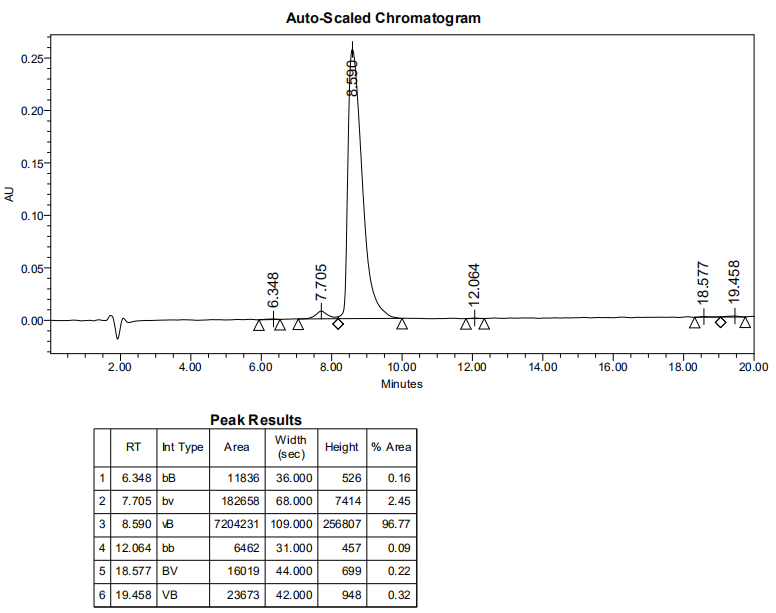
4、产品MS报告:

甲基化修饰多肽也叫甲基化标记多肽,甲基化修饰是蛋白质翻译后修饰(PTMs)的一种,几乎参与细胞所有的生命活动过程,发挥着重要的调控作用,蛋白质在甲基转移酶的催化下将甲基转移至特定的氨基酸残基上共价结合的过程。甲基化是一种可逆的修饰过程,由去甲基化酶催化去甲基化作用。研究发现,常见甲基化/去甲基化作用的氨基酸主要是赖氨酸(Lys)和精氨酸(Arg)研究表明,组蛋白赖氨酸甲基化修饰执行着多种生物学功能,如干细胞的维持和分化、X染色体失活、转录调节和DNA损伤反应等,主要是影响染色质浓缩,抑制基因表达。组蛋白精氨酸甲基化在基因转录调控中发挥着重要作用,并能影响细胞的多种生理过程,包括DNA修复、信号转导、细胞发育及癌症发生等因此专肽生物特地开发甲基化修饰多肽技术,为科学家在蛋白质翻译后修饰(PTMS)的研究中提供帮助。
根据多肽上甲基化氨基酸多肽修饰或标记的位置可以分为:
1. N端甲基化修饰(20种L型氨基酸氨基上增加一个甲基)
2. 侧链甲基化修饰 (Arg精氨酸甲基化多肽、Lys赖氨酸甲基化多肽)
根据甲基化修饰多肽的个数可以分为:
1. Arg(me)精氨酸单甲基修饰多肽
2. Arg(Me)2(Asymetrial)精氨酸非对称二甲基修饰多肽
3. Arg(Me)2(Symetrical)精氨酸对称二甲基修饰多肽
4. Lys(Me)赖氨酸单甲基修饰多肽
5. Lys(Me)2赖氨酸二甲基修饰多肽
6. Lys(Me)3赖氨酸三甲基修饰多肽
| 修饰名称 | 修饰简写 | 修饰结构 |
|---|---|---|
| 己酸 | Hex- | 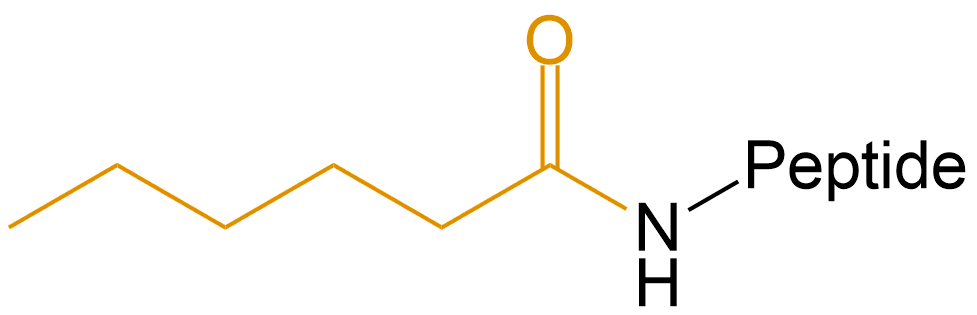 |
| 辛酸 | Oct- | 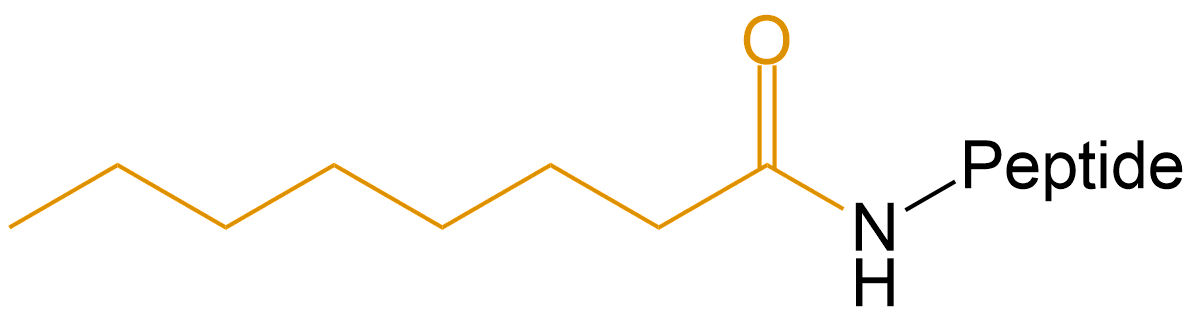 |
| 癸酸 | Dec- |  |
| 十一烷酸 | Undecyl- |  |
| 十二烷酸,月桂酸 | Lau- |  |
| 十四烷酸,肉豆蔻酸 | Myr- |  |
| 十六烷酸,棕榈酸 | Pal- |  |
| 十八烷酸, 硬脂酸 | Ste- | 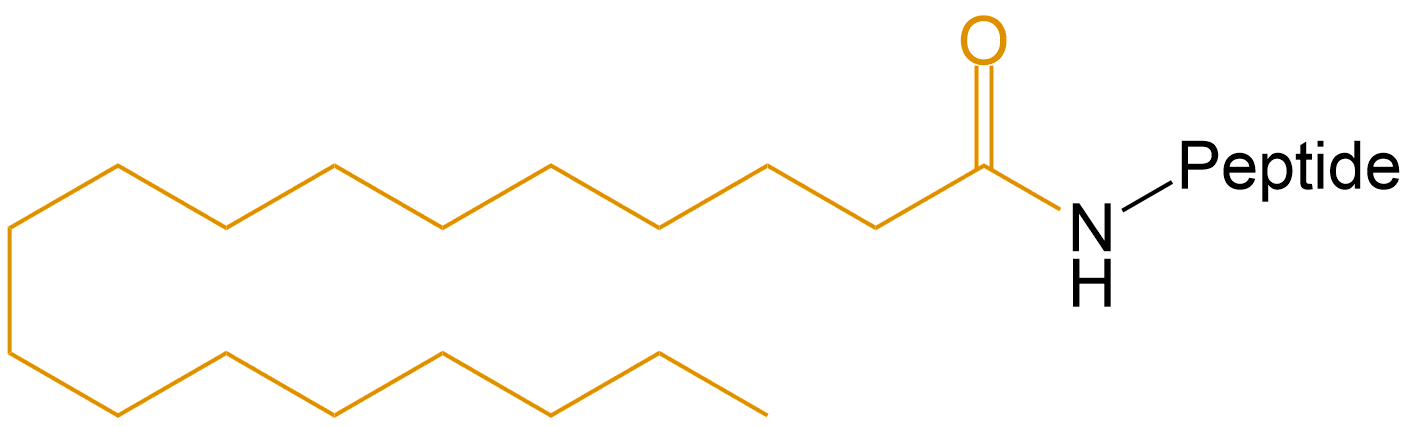 |
专肽生物提供同位素标记服务,如果您想让多肽分子量增加特定的道尔顿,我们可以根据多肽序列,为您选择合适的同位素氨基酸。
我们将同位素氨基酸大致分为以下几类。
1,D全标记
2,13C,14N全标
3,仅13C全标记
4,α-13C单标记
5,15N单标记,仅标记一
应用:1,随着对生长抑素(somatostatin,SST)及其类似物研究的日趋深入,利用放射性核素标记的ssT类似物与肿瘤细胞表面的生长抑素受体(somatostatin receptor,ssTR)特异性结合使肿瘤显像,从而达到定位、定性诊断的目的,已成为当今核医学领域研究的主要内容之一。

放射性金属元素,例如: Cu、 Ga、 Lu、等可以通过与富含氨基或羧基配体的螯合作用引入多肽分子,在正电子发射计算机断层显像(PET)技术中发挥重要的作用,被广泛地应用于肿瘤的诊断研究。
专肽生物可对所生产的多肽标记与放射性金属螯合的配体,满足客户相应的研究需求(注:专肽生物不提供螯合放射性金属元素的服务)。以下是一些常见的、客户所选择的螯合配体:
| 配体简写 | 配体名称 | 结构 |
|---|---|---|
| DOTA | 1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸 | 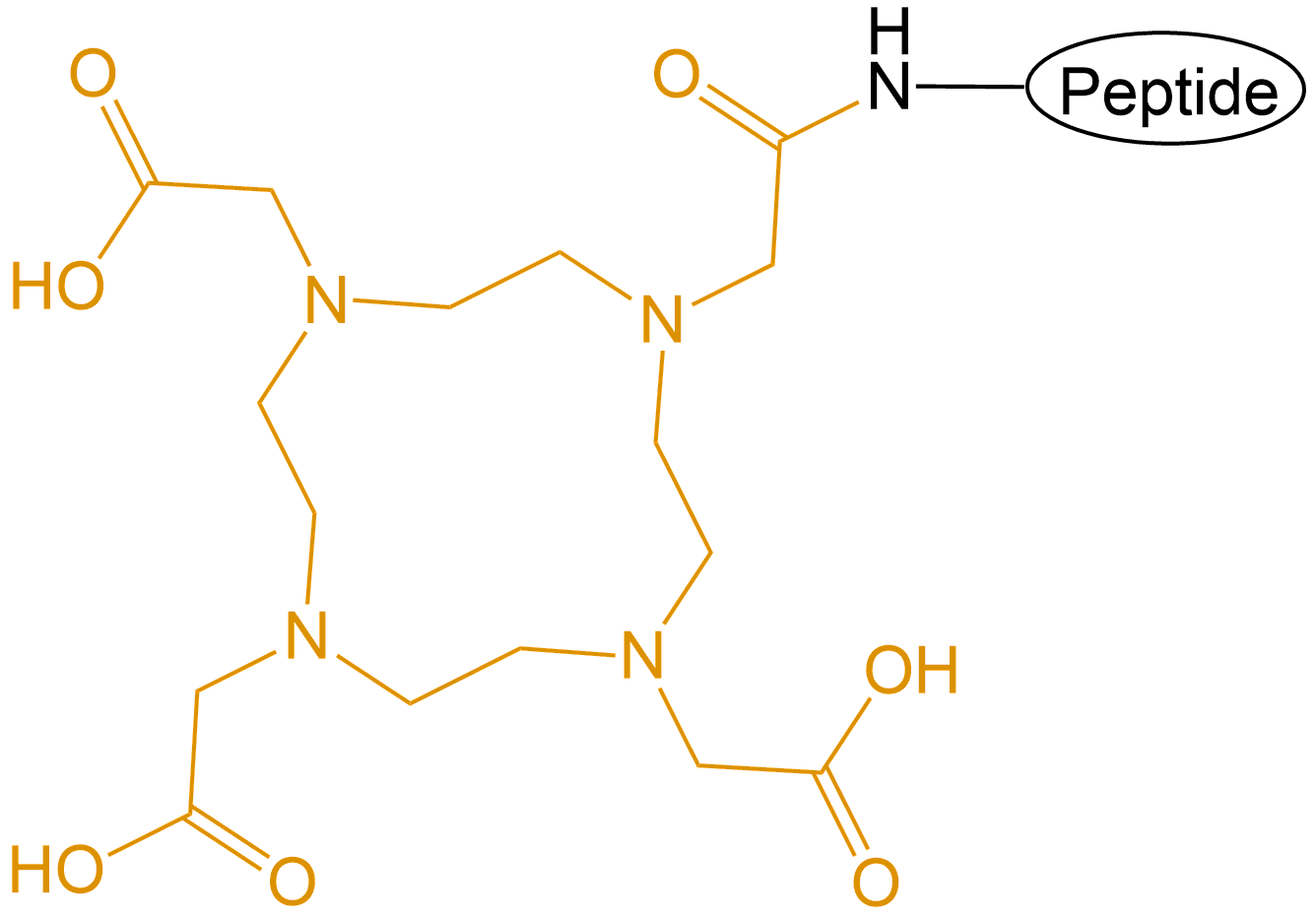 |
| NOTA | 1,4,7-三氮杂环壬烷-N,N',N''-三乙酸 | 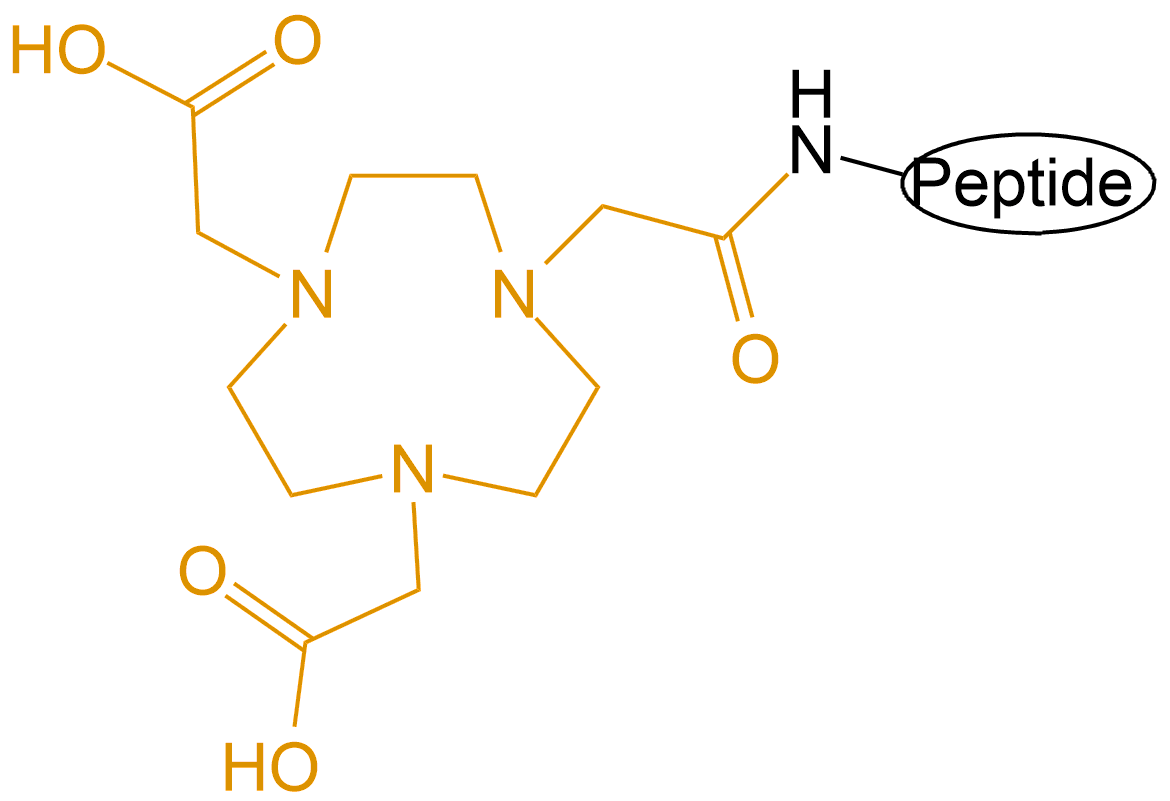 |
| DTPA | 二乙烯三胺五醋酸 | 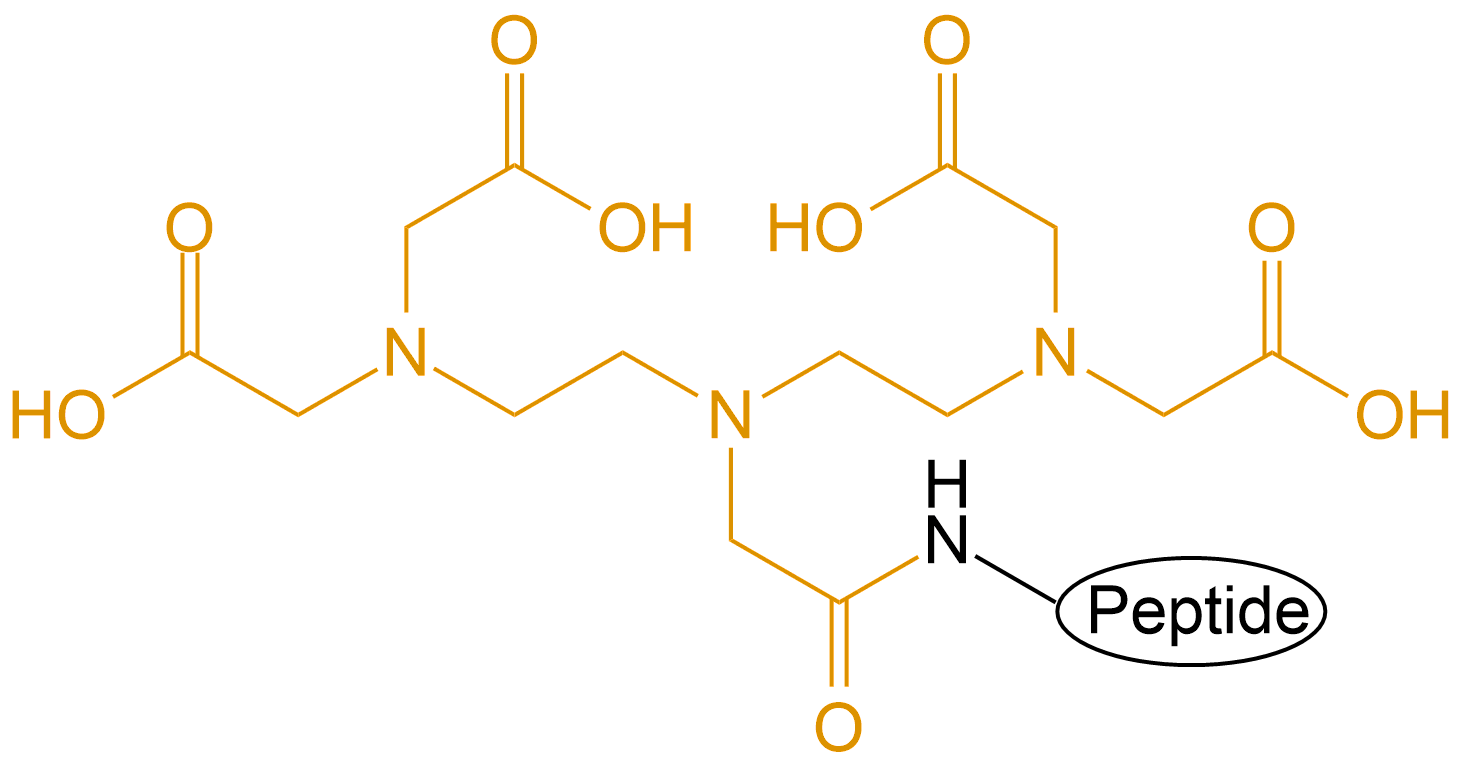 |
聚乙二醇(PEG),也称为聚环氧乙烷(PEO),是可溶于水和大多数有机溶剂的两亲性聚醚。PEG及其衍生物是可用于由美国FDA认证的生物药物产品的少数聚合物之一。
PEG修饰是指将PEG聚合物链共价连接到靶分子,通常是小分子化学药物或大生物分子如肽,蛋白质,碳水化合物,脂质,寡核苷酸,亲和配体,辅因子,脂质体和其他生物材料。而作为药物先导化合物的多肽分子在体内的应用受到一定程度的限制,主要体现在生物体肾小球的过滤作用、体内蛋白酶的水解破坏作用以及因多肽分子引起的体内抗原反应。将多肽用PEG修饰后(Pegylation),上述三方面的限制均大幅减小,从而提高了多肽在生物体内的应用。
专肽生物可对所合成的多肽进行各种不同类型的PEG修饰,以满足客户的不同需求。主要修饰位点在多肽的N端、C端,Lys侧链和Cys的巯基。修饰所用PEG单分子分子量区间在PEG2~PEG24之间;PEG大分子分子量区间在PEG500~PEG40K之间。
| PEG分类 | 修饰简写 | 细节说明 | 修饰位置 | PEG结构 |
|---|---|---|---|---|
| 小分子PEG | PEG2、mini-PEG、AEEA | 右侧可选乙酸或羧基两种形式 | 肽链N端、C端、Lys侧链、肽中间等 | 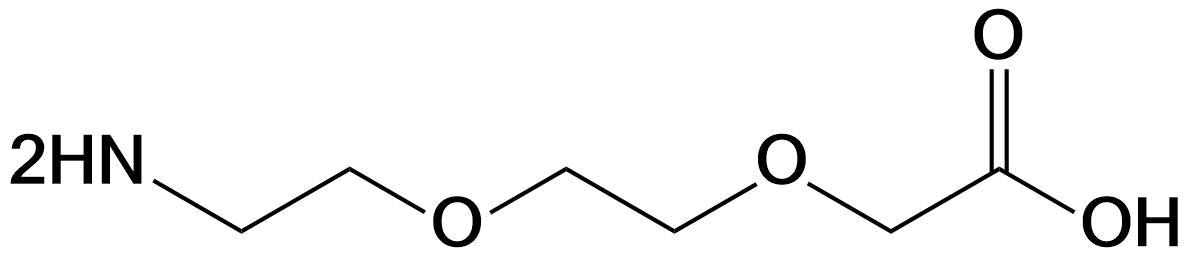 |
| PEG3、mini-PEG3、AEEEA | 右侧可选乙酸或羧基两种形式 | 肽链N端、C端、Lys侧链、肽中间等 | 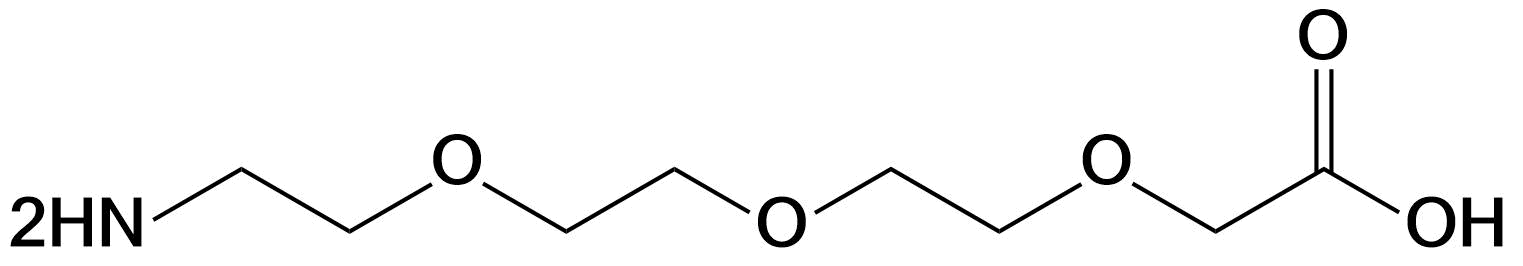 |
|
| PEG4 | 右侧可选乙酸或羧基两种形式 | 肽链N端、C端、Lys侧链、肽中间等 | 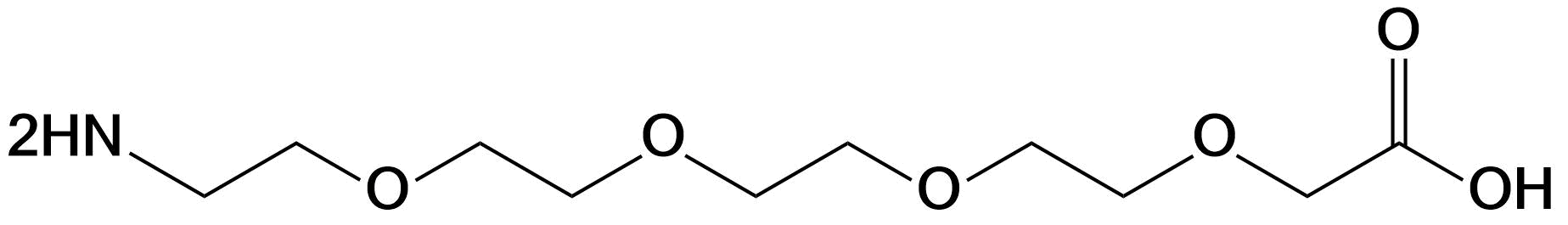 |
|
| PEG6 | 右侧可选乙酸或羧基两种形式 | 肽链N端、C端、Lys侧链、肽中间等 |  |
|
| 高分子PEG | mPEG-NH2 | 500、550、750、1000、2000、5000等 | 肽链C端,或Asp侧链 |  |
| NH2-PEG-NH2 | 1000 、2000 、3400 、5000、10000、20000、40000等 | 肽链C端,或Asp侧链 | 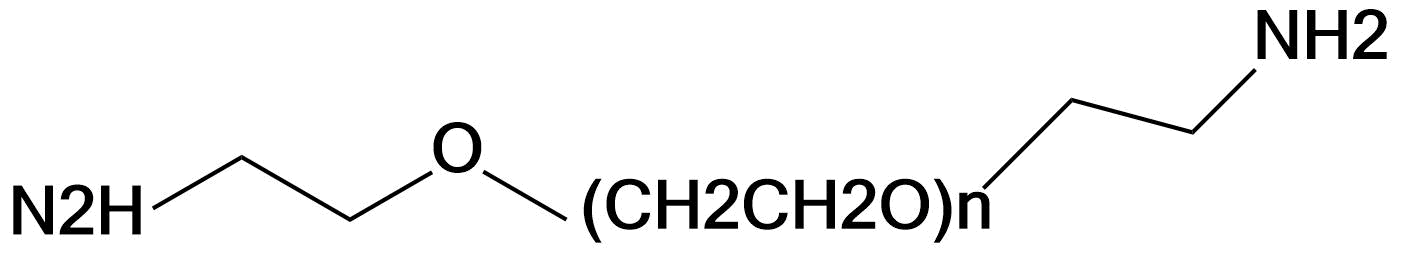 |
|
| NH2-PEG-COOH | 1000 、2000 、3400 、5000、10000、20000、40000等 | 肽链C端,或Asp侧链 |  |
|
| NH2-PEG-Galactose | 2000、3400、5000等 | 肽链C端,或Asp侧链 |  |
|
| mPEG-COOH | 500、550、750、1000、2000、5000等 | N端修饰 |  |
|
| HO-PEG-COOH | 2000、5000等 | N端修饰 |  |
|
| COOH-PEG-COOH | 550、750、1000、2000等 | N端修饰 |  |
点击化学(Click chemistry),又称为“链接化学”或“动态组合化学,其主旨是通过小单元的拼接,来快速可靠地完成各种分子的化学合成。点击化学的代表反应为铜催化的叠氮-炔基Husigen环加成反应。点击化学在多肽化学中的应用主要体现为一条肽链中的炔基和另一条肽链中的叠氮基通脱1,3-偶极环加成反应形成三氮唑五元环结构。此结构能稳固多肽与蛋白质的空间结构,快速偶联两条肽链,同时使肽链的二级结构(α-螺旋和β-折叠)发生改变来改变其生物活性。点击化学的反应条件比较接近人体的生理环境,反应时间短,可以防止蛋白质的变性。
点击化学反应可分为三类:
(1) Cu(I)催化叠氮化物-炔烃点击化学反应(CuAAC);
(2) 菌株促进叠氮化物-炔烃点击化学反应(SPAAC)。它具有生物相容性。
(3) 四嗪和烯烃(反式环辛烯)之间的配位作用。这种高速反应也是不含铜的,这是体内细胞标记的理想选择。
Click Chemistry由于其温和的条件和高的选择性,已被广泛用于制药和生物技术行业的生物共轭,生物标记和材料科学。 Click化学工具具有广泛的功能基团:叠氮化物,炔烃,DBCO,TCO,四嗪,BCN ...
专肽生物提供将多种Click结构添加到多肽结构中,以满足广大科研人员的实验要求。
| 分类 | 说明 | 修饰结构 | 原料名称 | 简写 | 修饰位置 |
|---|---|---|---|---|---|
|
引入叠氮 |
叠氮化物试剂使Click Chemistry成为可能,并可用于与含胺的生物分子反应,修饰羧酸基团等。 | 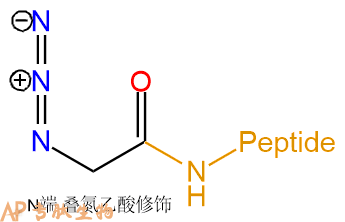 |
2-叠氮乙酸 | N3-Gly- | 肽链N端、Lys侧链 |
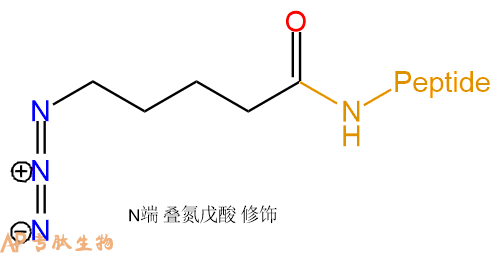 |
5-叠氮戊酸 | N3-Ava- | 肽链N端、Lys侧链 | ||
 |
6-叠氮己酸 | N3-Acp- | 肽链N端、Lys侧链 | ||
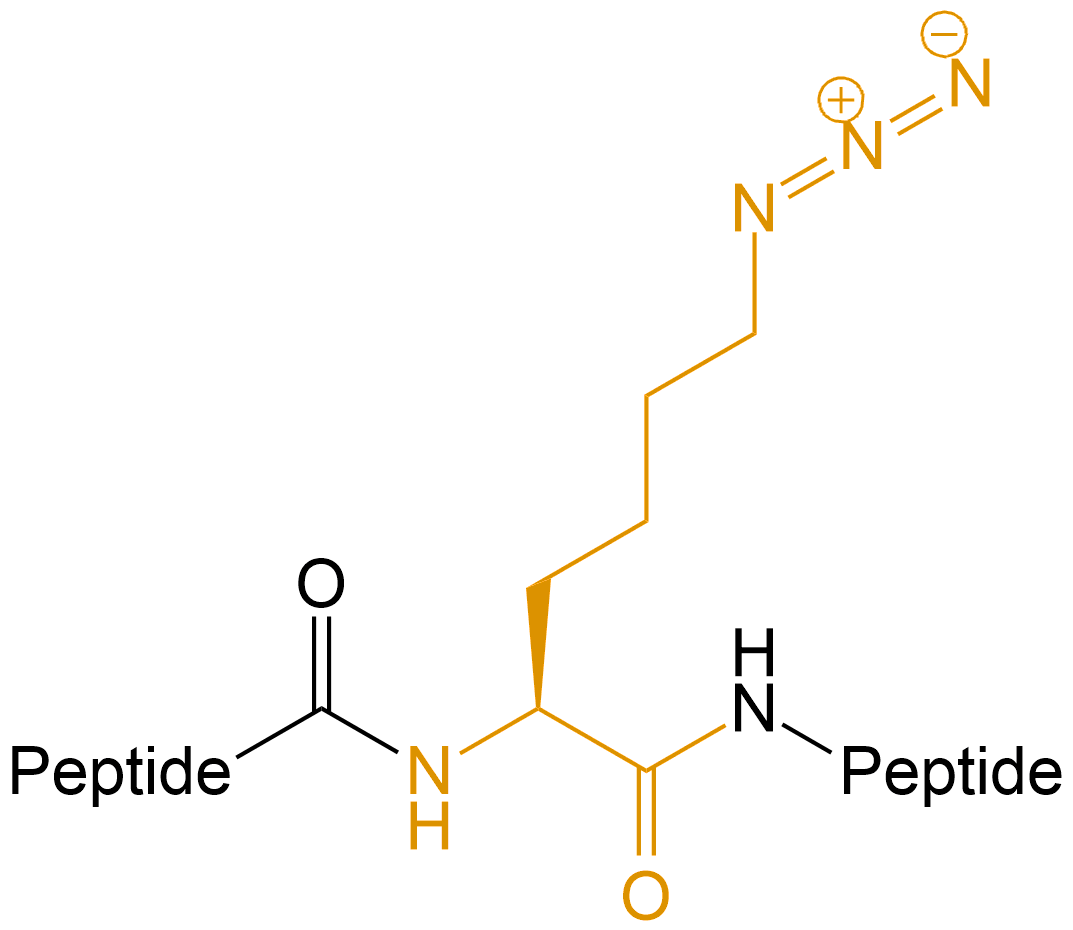 |
Lys(N3) | -Lys(N3)-、-K(N3)- | 类似于氨基酸,任意位置,如N端,C端,肽段中间 | ||
| 引入烯基 | 烯基化物试剂使Click Chemistry成为可能,并可用于与含胺的生物分子反应,修饰羧酸基团等。 | 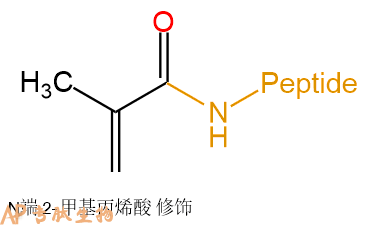 |
2-甲基丙烯酸 | Methacryl- | 肽链N端、Lys侧链 |
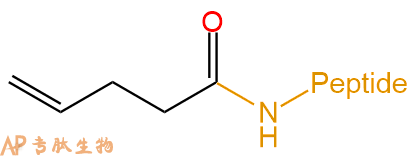 |
4-戊烯酸 | pentenoic acid- | 肽链N端、Lys侧链 | ||
 |
5-己烯酸 | 5-heptenoic acid- | 肽链N端、Lys侧链 | ||
| 引入炔基 | 炔烃试剂可通过铜催化的叠氮化物-炔烃Click化学与含叠氮化物的化合物或生物分子反应,以产生稳定的三唑键。 | 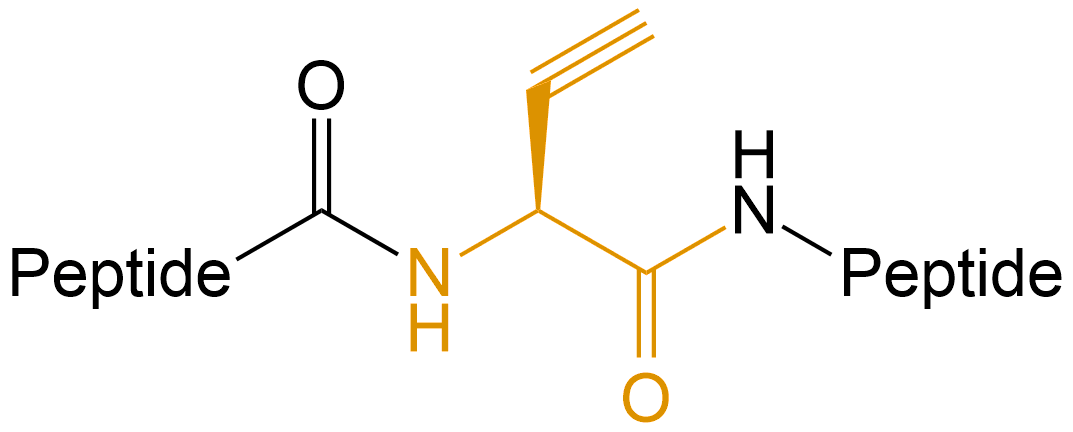 |
N-炔丙基甘氨酸 | N-Propargylglycine- | 肽链N端、C端、Lys侧链、肽的中间等 |
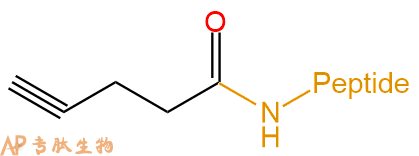 |
4-戊炔酸 | Pentinoyl- | 肽链N端、Lys侧链 | ||
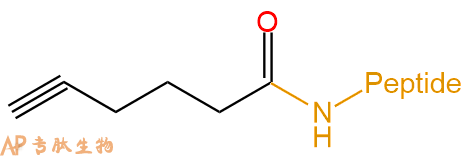 |
5-己炔酸 | 5-Hexynoic acid- | 肽链N端、Lys侧链 | ||
|
Bicyclo[6.1.0]nonyne BCN试剂 |
BCN试剂(双环[6.1.0] nonyne)可以通过无铜的Click Chemistry与叠氮化物标记的分子或生物分子反应。 | 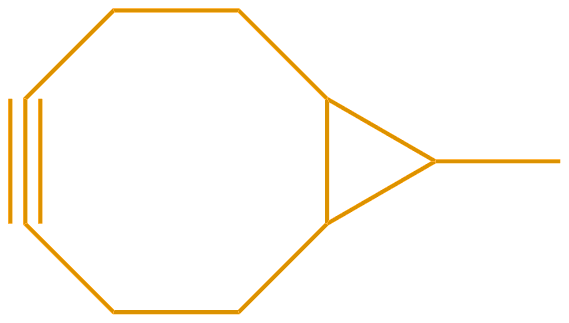 |
BCN试剂 | BCN | \ |
|
Dibenzocyclooctyne 二苯并环辛炔 |
DBCO(二苯并环辛炔)试剂是用于应变促进的炔叠氮化物环加成(SPAAC)的最具反应性的环炔烃之一,可实现无铜点击化学。 | 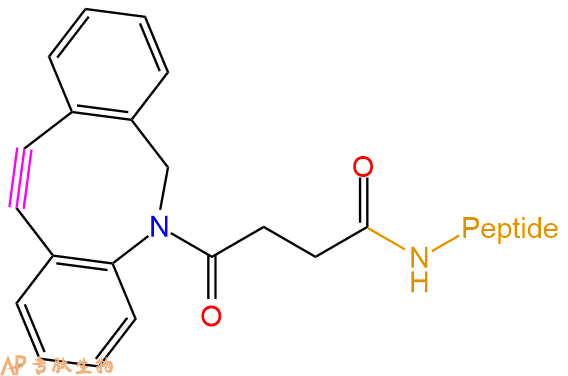 |
二苯并环辛炔 | DBCO | 肽链N端、C端、Lys侧链、肽的中间等 |
|
Trans-Cyclooctene Reagents 反式环辛烯试剂 |
TCO试剂(反式环辛烯试剂)可用于通过无铜Click Chemical标记抗体,蛋白质和其他大分子。 | 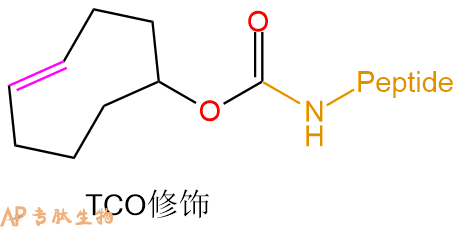 |
反式环辛烯试剂 | TCO | 肽链N端、Lys侧链 |
|
Tetrazine reagents Tetrazine试剂 |
Tetrazine试剂可用于许多应用,例如抗体标记和蛋白质修饰。发现川嗪以反式-环辛烯(TCO)作为亲二烯体进行生物正交反应的动力学最快。与甲基四嗪相比,四嗪的化学稳定性较低。 | 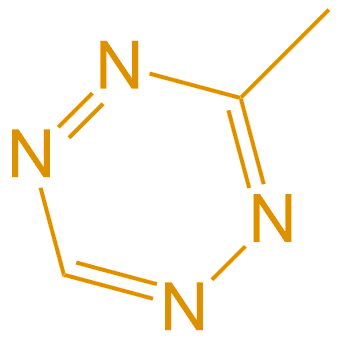 |
Tetrazine试剂 | Tetrazine | \ |
1、产品序列:Propargyl-PEG6-KKK-NH2
2、产品结构:
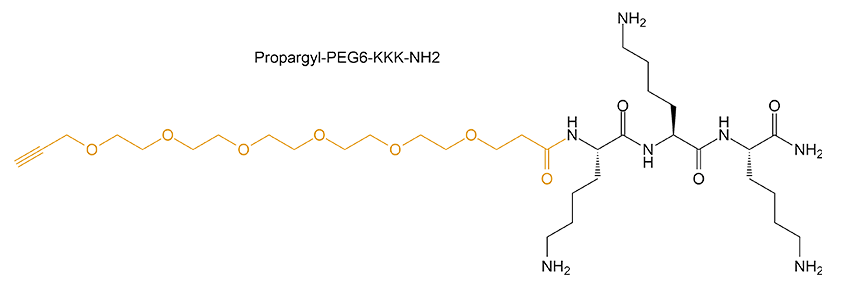
3、产品HPLC图谱

4、产品MS图谱
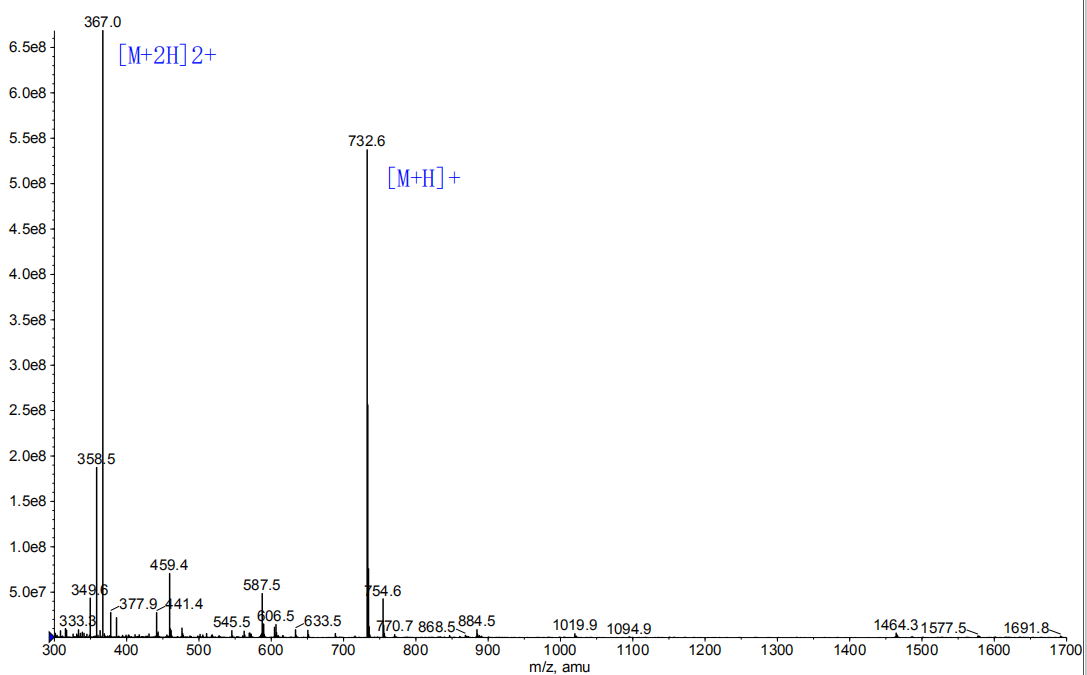
生物素-亲合素系统 (biotin-avidin system,BAS),是70年代后期应用于免疫学,并得到迅速发展的一种新型生物反应放大系统。由于它具有生物素与亲合素之间高度亲和力及多级放大效应,并与荧光素、酶、同位素等免疫标记技术有机地结合,使各种示踪免疫分析的特异性和灵敏度进一步提高。主要有用于标记多肽氨基的生物素N-羟基丁二酰亚胺酯(BNHS)和生物素对硝基酚酯(pBNP),其中以BNHS最常用,当然,也可以直接使用生物素也可以标记,因为其结构上有个游离的羧基,采用HBTU/HOBt/DIEA方法缩合,由于生物素的溶解度低,使用DMSO/DMF的混合溶剂增加溶解度。
此外生物素是复合维生素B2的组成部分。它与鸡清蛋白、亲和素、真菌蛋白、链霉亲和素均有较高亲和性和结合力。亲和素和 链霉亲和素都是四聚体蛋白,可紧紧地结合四分子D-biotin,其结合力是已知自然界中最强的非共价作用。生物素与亲和素之间的相互作用可用于蛋白纯化、检测、固化、药物导向和蛋白质结构分析等方面。多肽生物素标记常在肽的N端或Lys侧链;肽链 C端也可用Biotin标记,此时肽链C端需引入Lys或者乙二胺结构。
| 生物素标记位置 | 结构展示 |
|---|---|
| 多肽N端 | 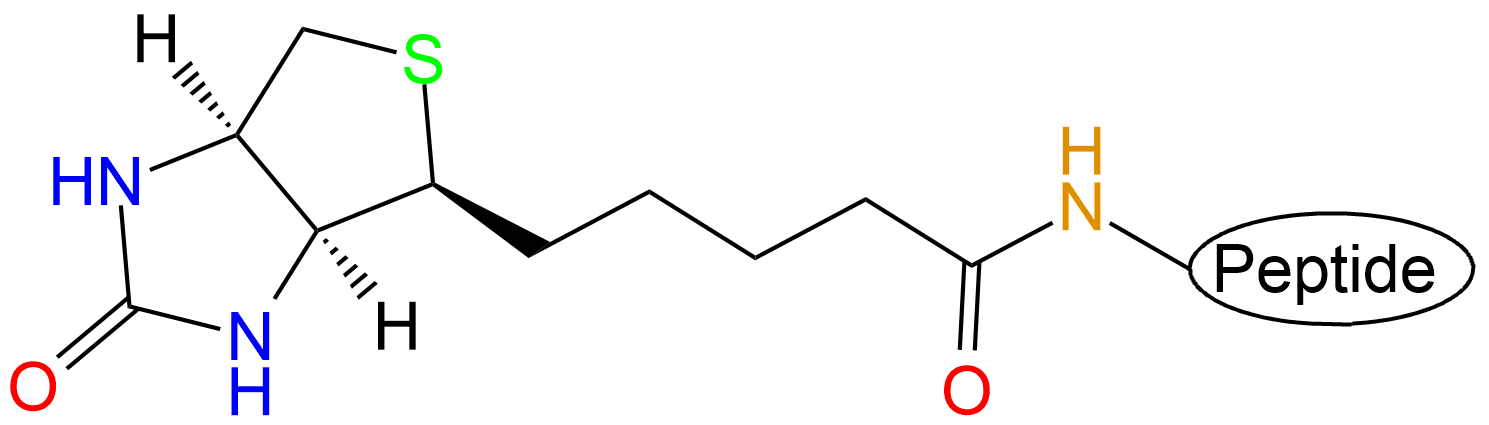 |
| Lys侧链 | 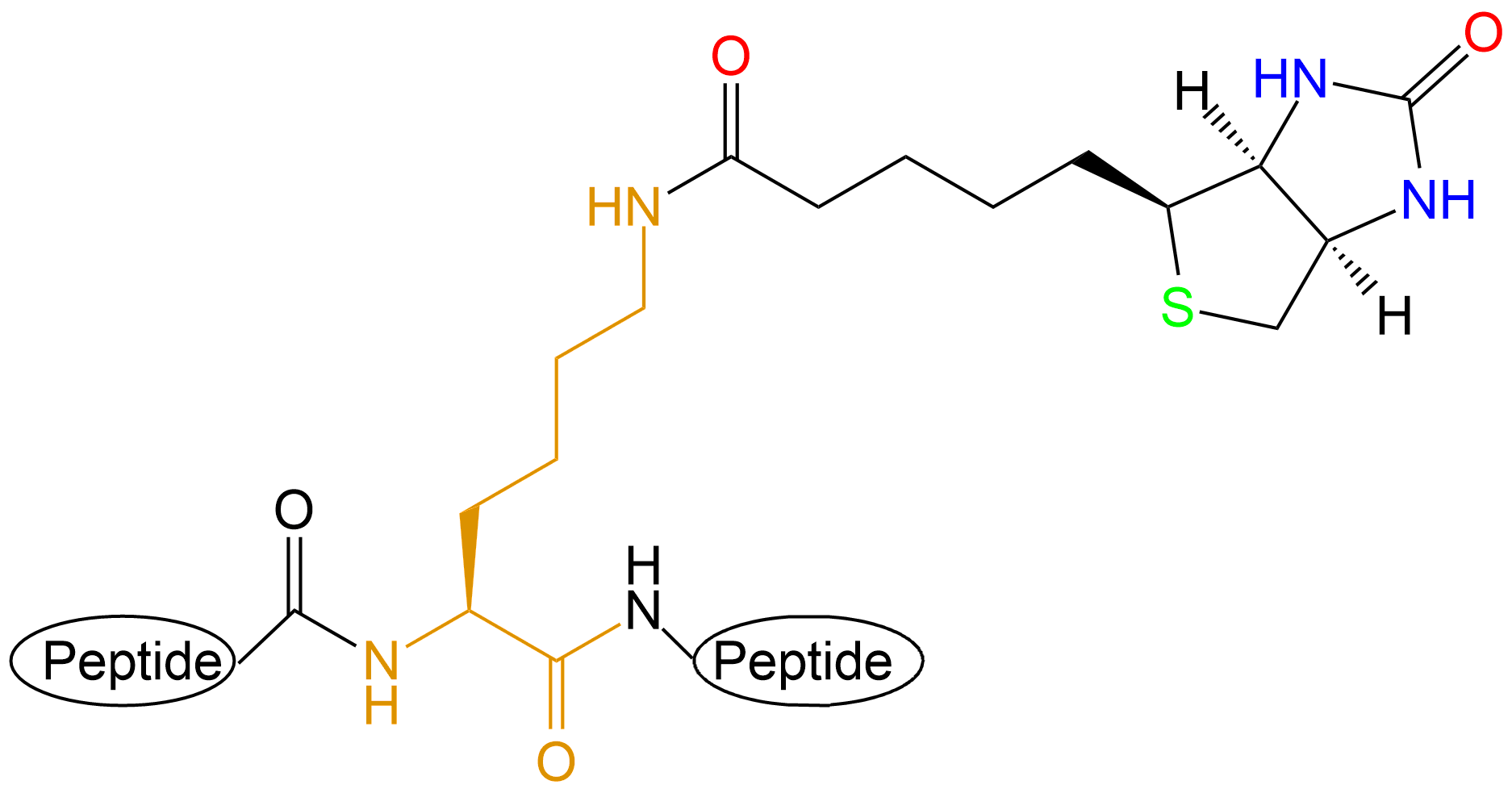 |
| 多肽C端 | 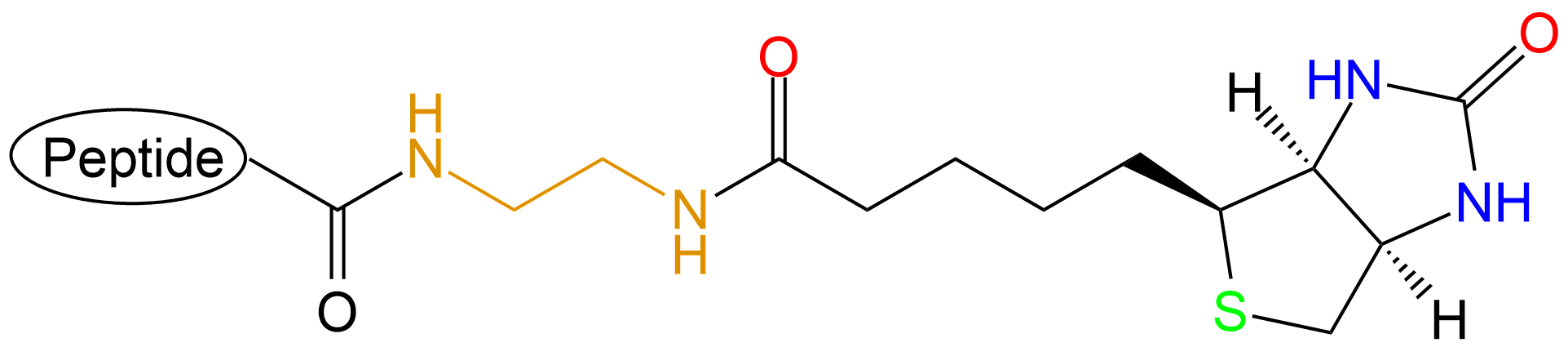 |
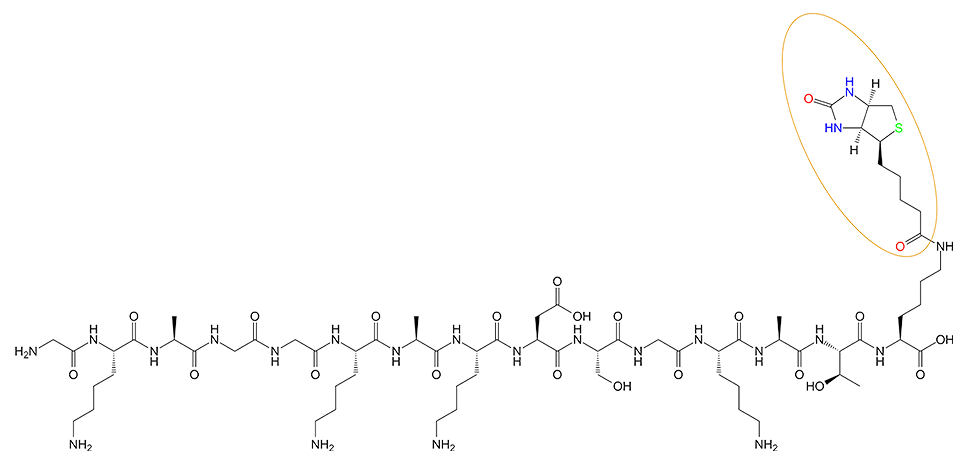
1、产品序列:H-Gly-LysAla-Gly-Gly-Lys-Ala-Lys-Asp-Ser-Gly-Lys-Ala-Thr-Lys(Biotin)-OH
2、产品结构:
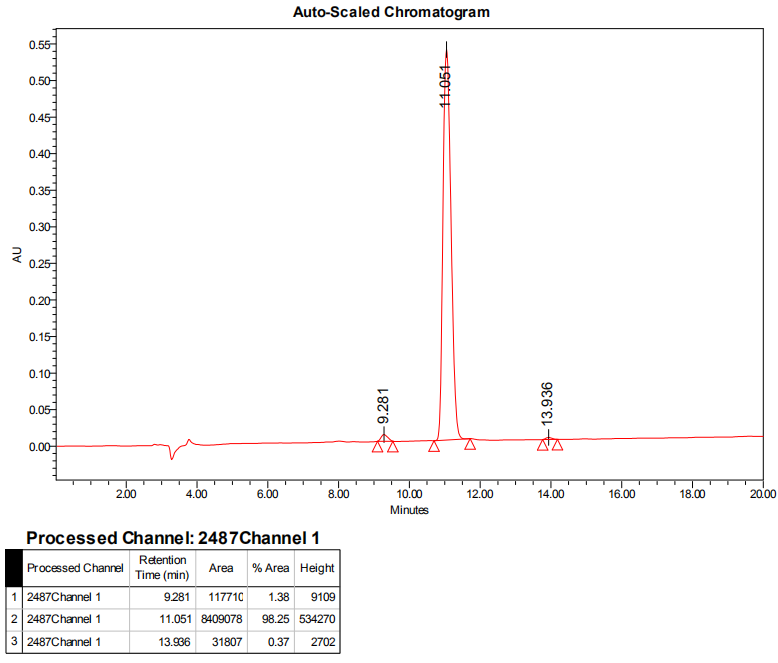
3、HPLC图谱
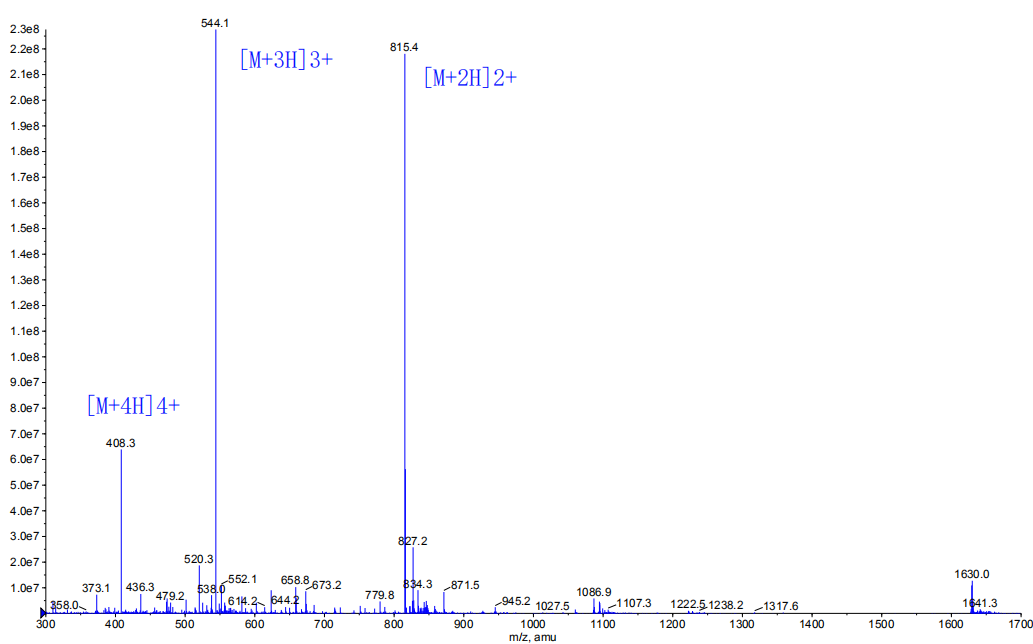
4、MS图谱
专肽生物提供各种环状多肽的定制合成服务。
| 成环修饰分类 | 成环修饰名称 | 成环修饰结构展示 |
|---|---|---|
| 酰胺成环 | 首尾酰胺键成环 | 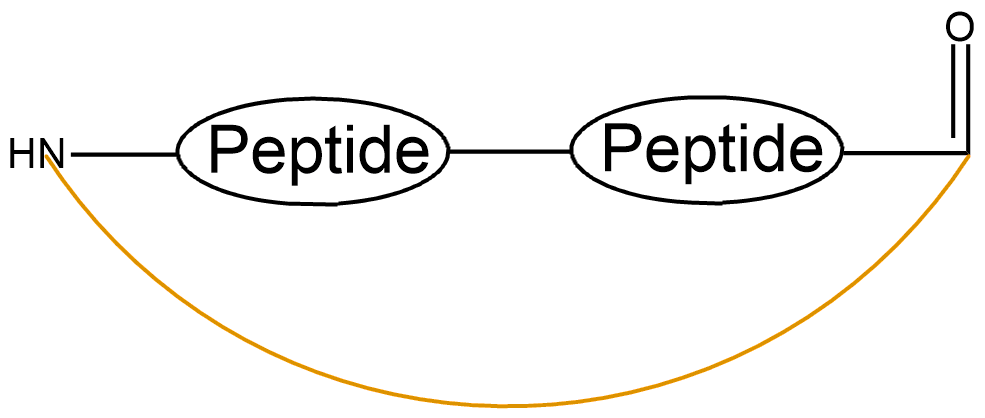 |
| C端与中间Lys或Orn酰胺成环 | 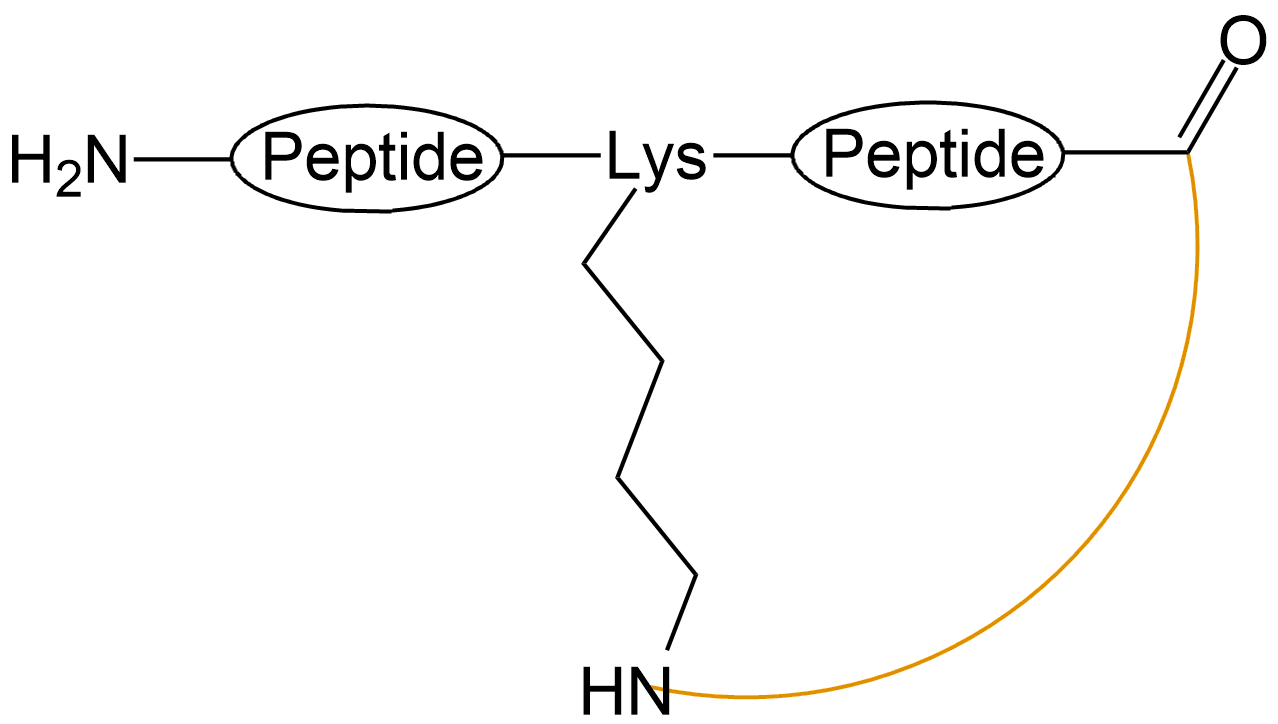 |
|
| N端与中间Asp或Glu酰胺成环 | 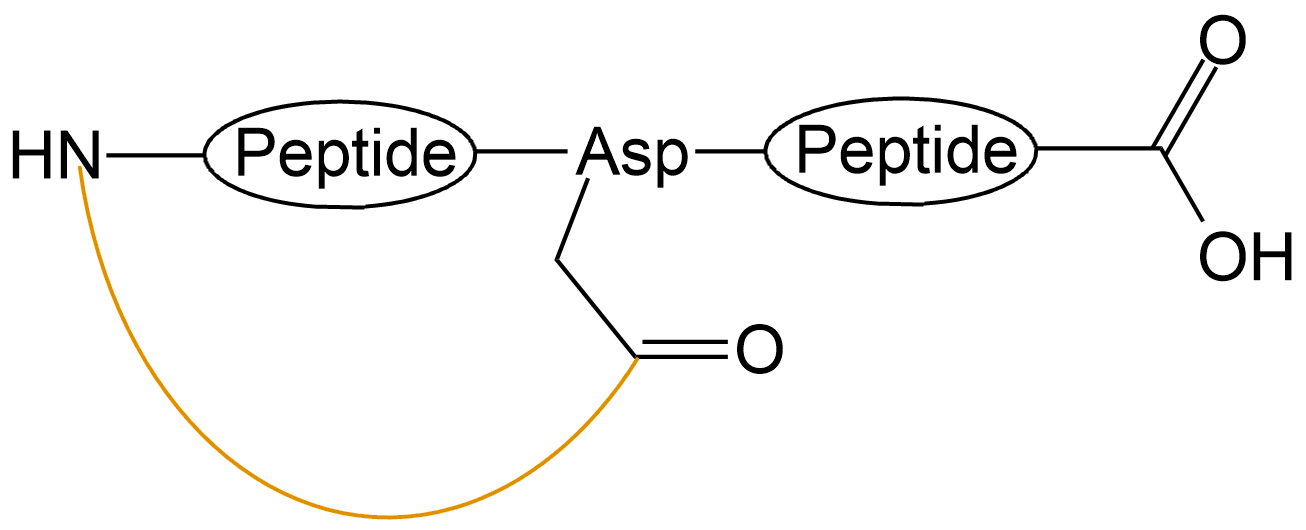 |
|
| 中间酰胺成环 | 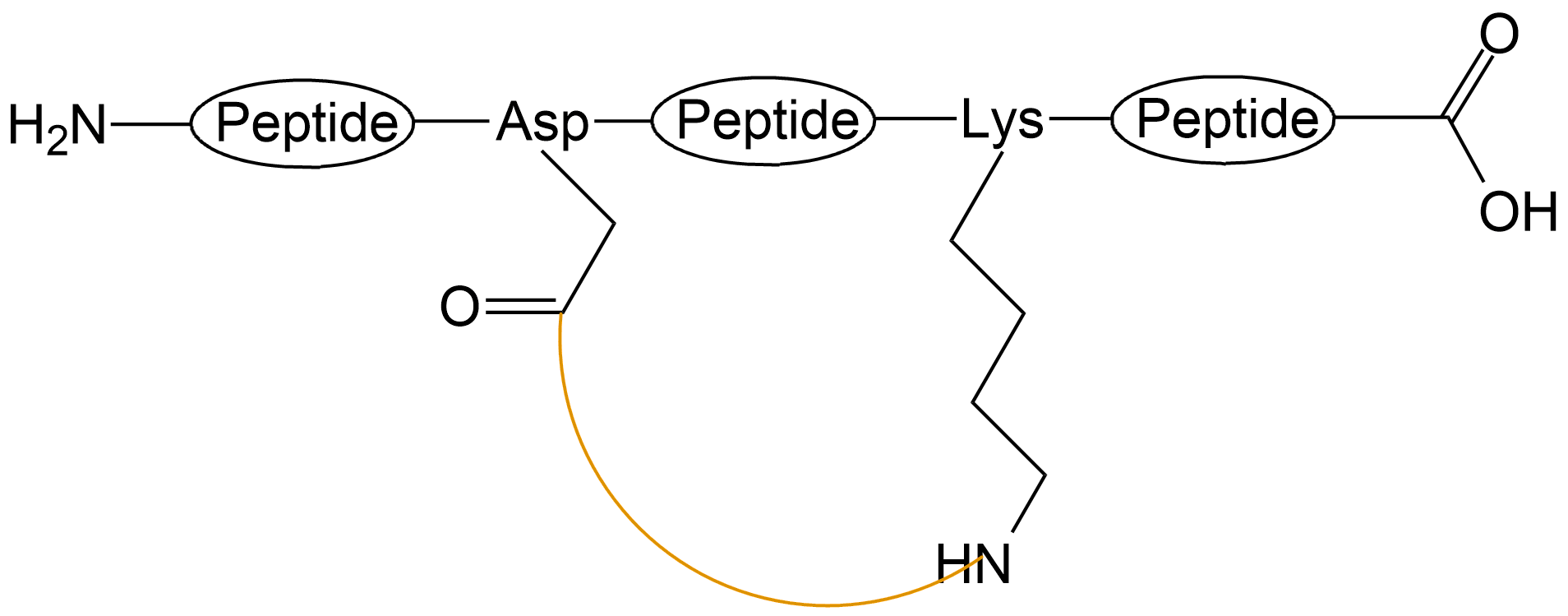 |
|
| 二硫键成环 | 分子内一对二硫键 |  |
| 分子内两对二硫键 | 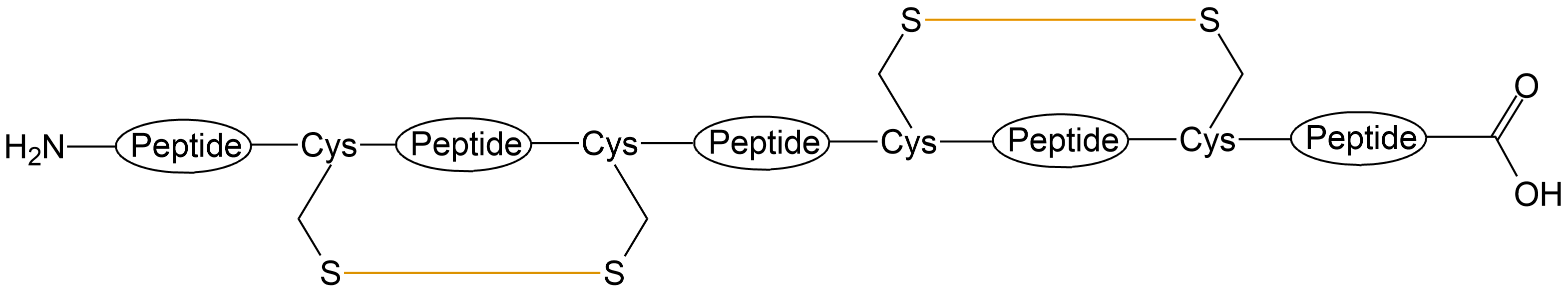 |
|
| 分子内三对二硫键 | 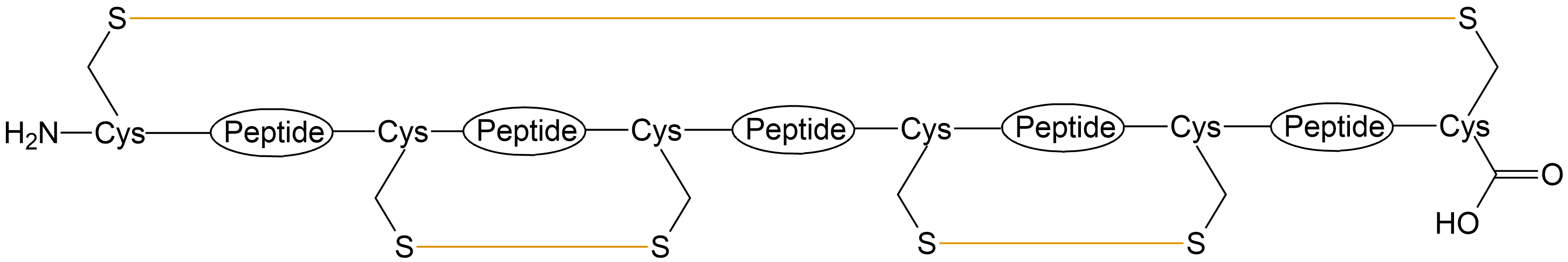 |
|
| 分子间一对二硫键 | 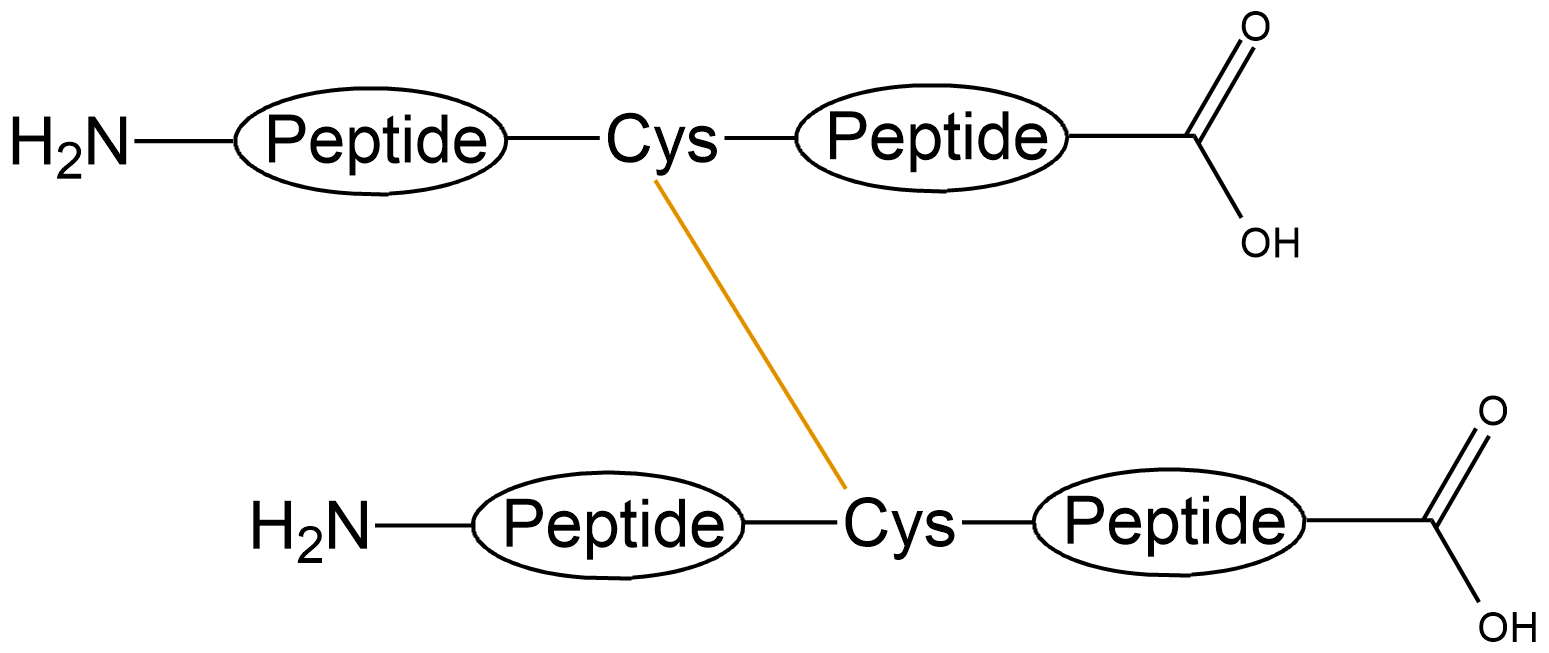 |
|
| 分子间两对二硫键 | 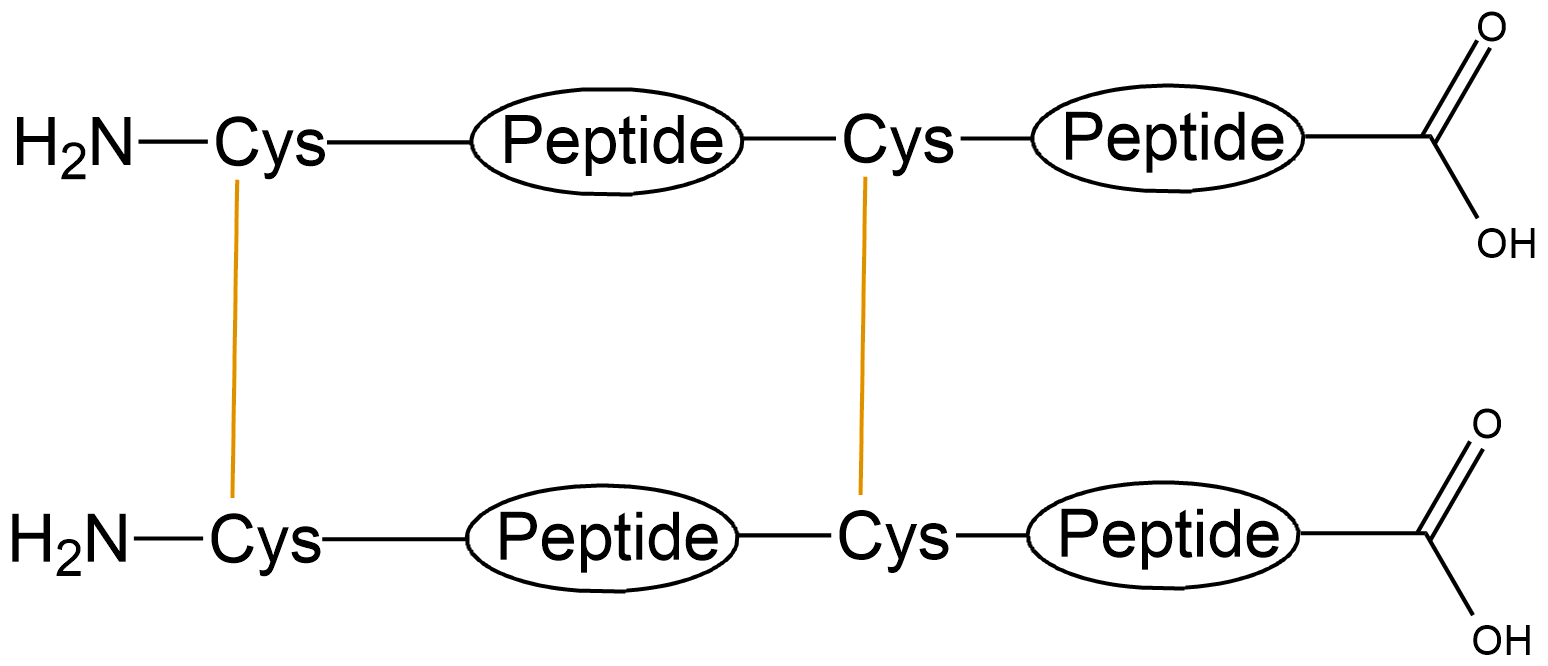 |
|
| 酯键成环 | 普通酯键成环 |  |
| 硫酯键成环 |  |
|
| 醚键成环 | 普通醚键成环 | 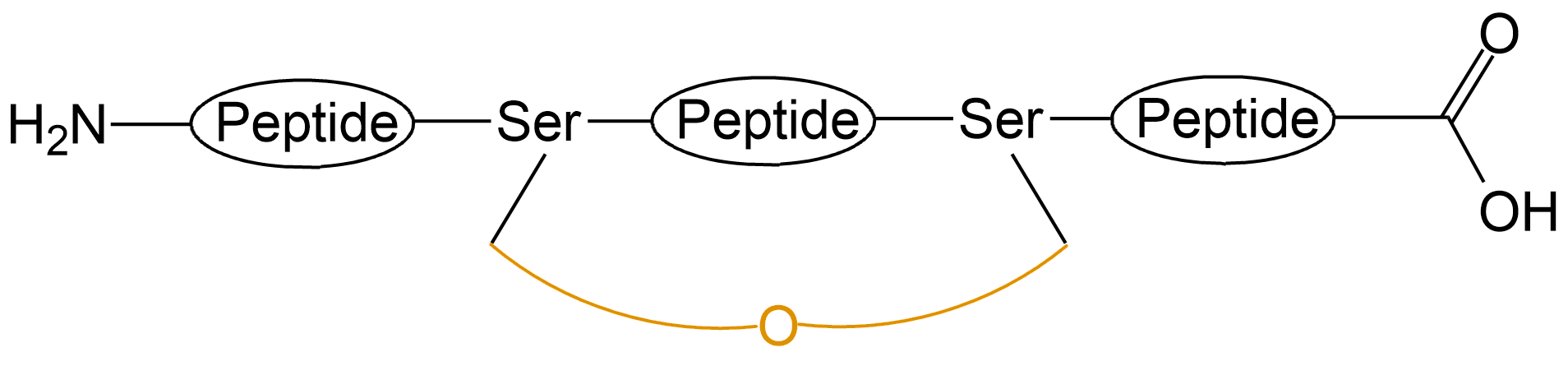 |
| 硫醚键成环 | 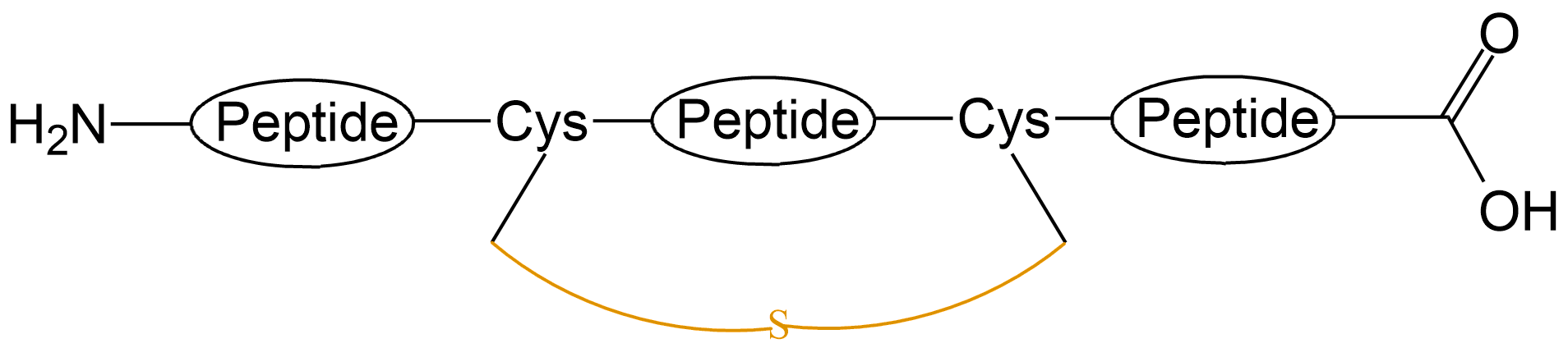 |
|
| 脲基成环 | 普通脲基成环 | 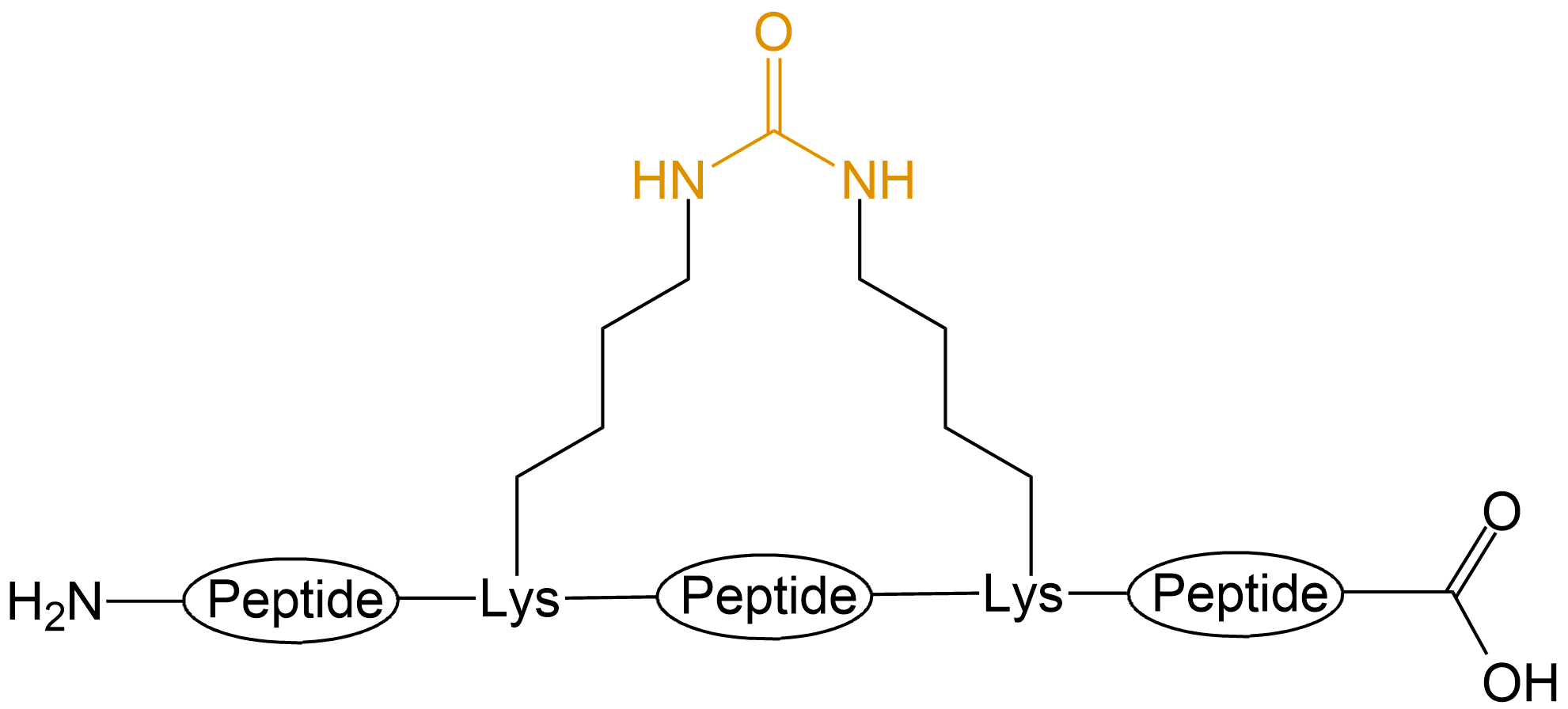 |
| 硫脲成环 |  |
|
| CLIPS环 | 1-CLIPS | 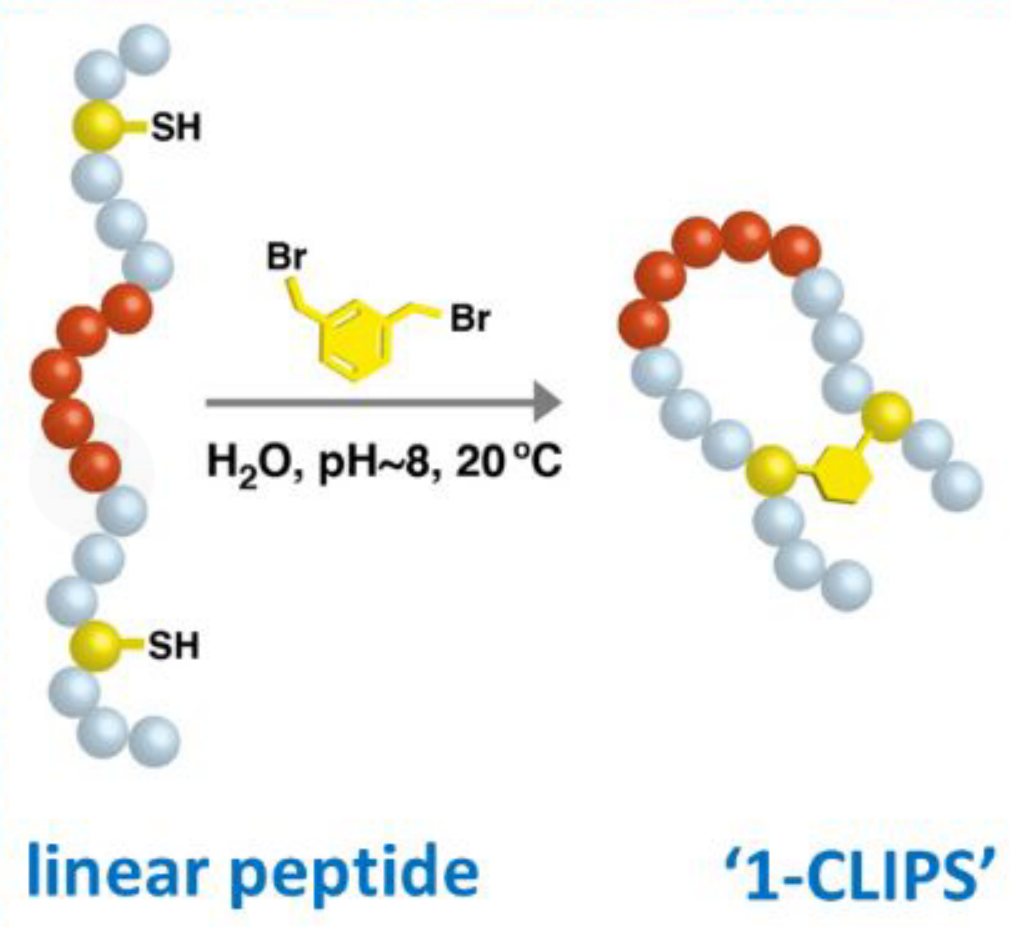 |
| 2-CLIPS | 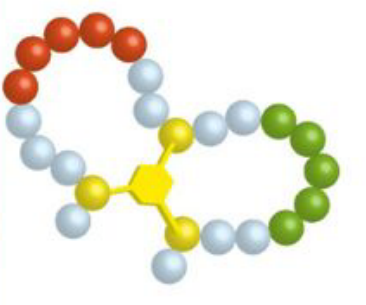 |
|
| 3-CLIPS | 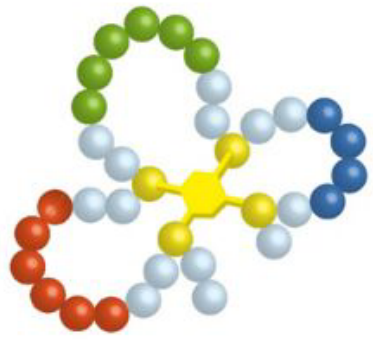 |
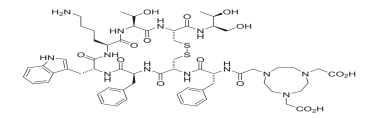
1、产品结构:
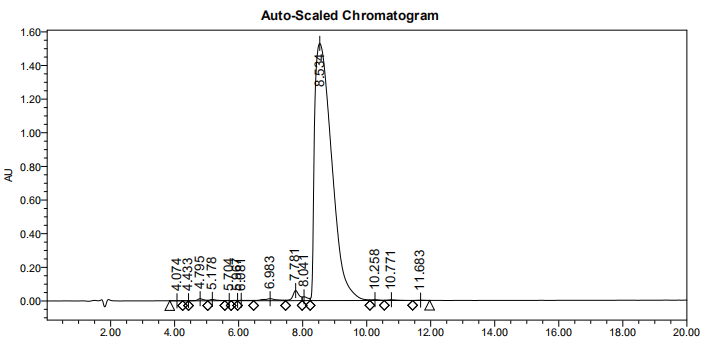
2、HPLC图
3、MS图
为满足科研人员对多肽的各种要求,杭州专肽生物可以将一些特殊氨基酸插入到多肽序列中,前面已有各种D型、甲基化氨基酸和同位素标记氨基酸,此处展示其它特殊氨基酸。
| 特殊氨基酸的名称 | 氨基酸简写 | 结构展示 |
|---|---|---|
| 硒代半胱氨酸 | Sec | 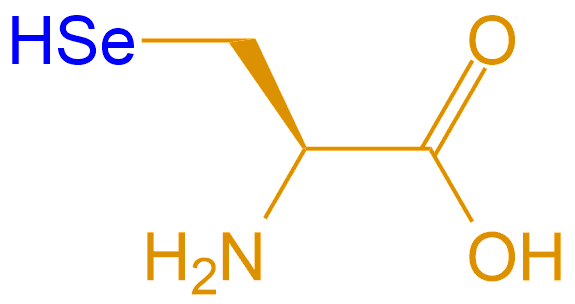 |
| 侧链乙酰化赖氨酸 | Lyc(Ac) | 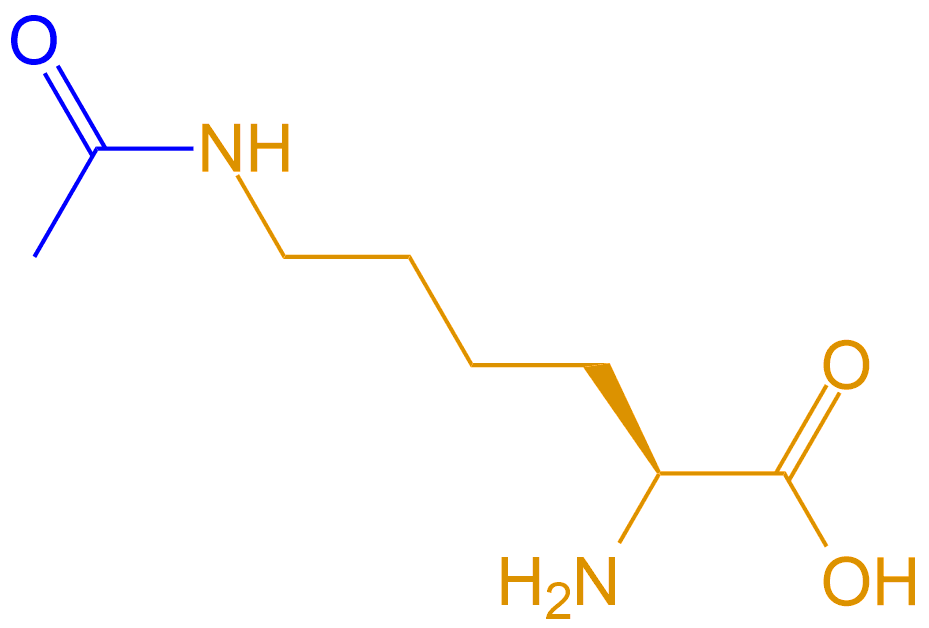 |
| 鸟氨酸 | Orn | 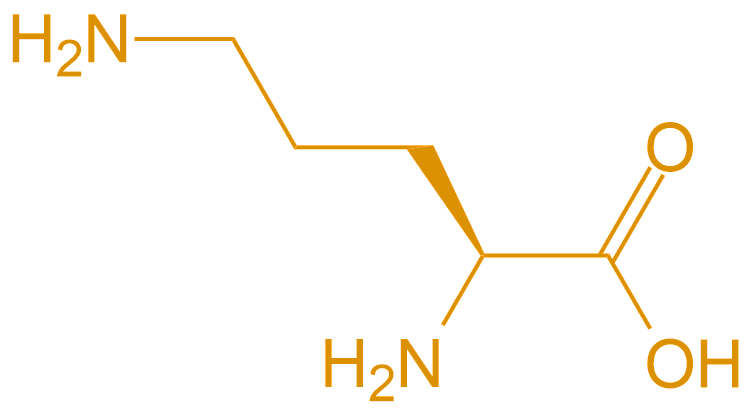 |
| 2,4-二氨基丁酸 | Dab | 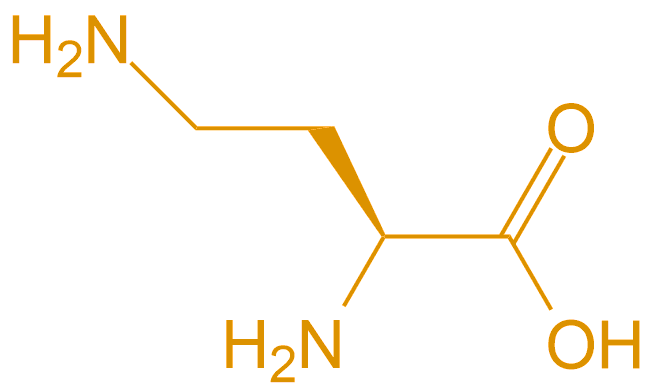 |
| 2,3-二氨基丙酸 | Dap | 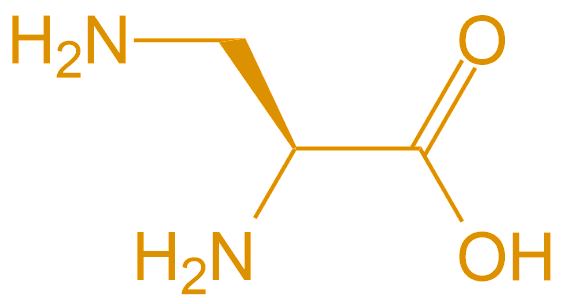 |
| 正亮氨酸 | Nle |  |
| 4-氨基丁酸 | GABA |  |
| α-氨基辛二酸 | Asu |  |
| 苯甘氨酸 | Phg | 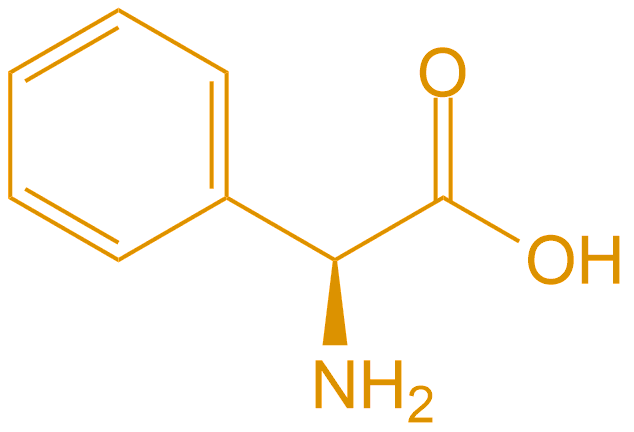 |
|
炔丙基甘氨酸 Propargylglycine |
Pra | 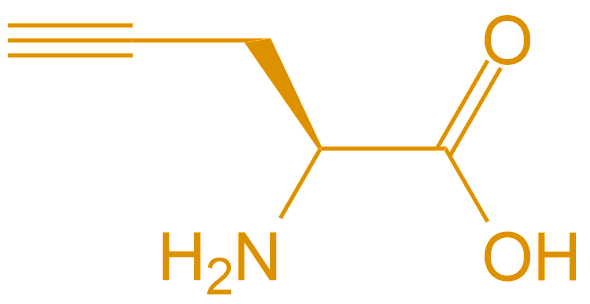 |
| D-炔丙基甘氨酸 | D-Pra | 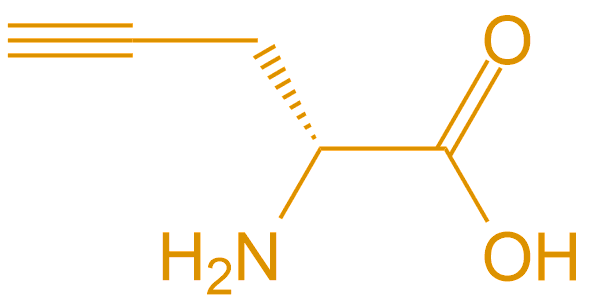 |
|
羟脯氨酸 L-Hydroxyproline |
Hyp |  |
|
D-羟脯氨酸 D-Hydroxyproline |
D-Hyp | 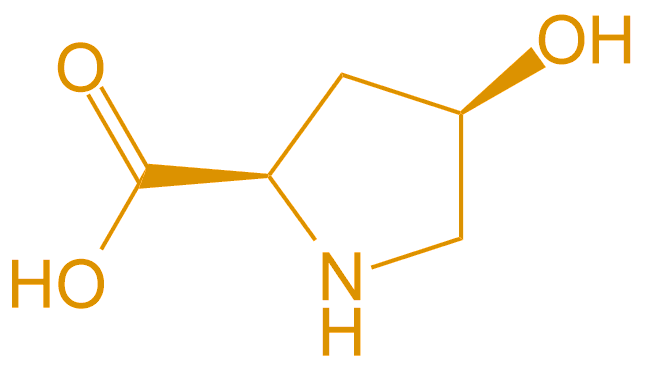 |
|
胍氨酸 Citrullin |
Cit | 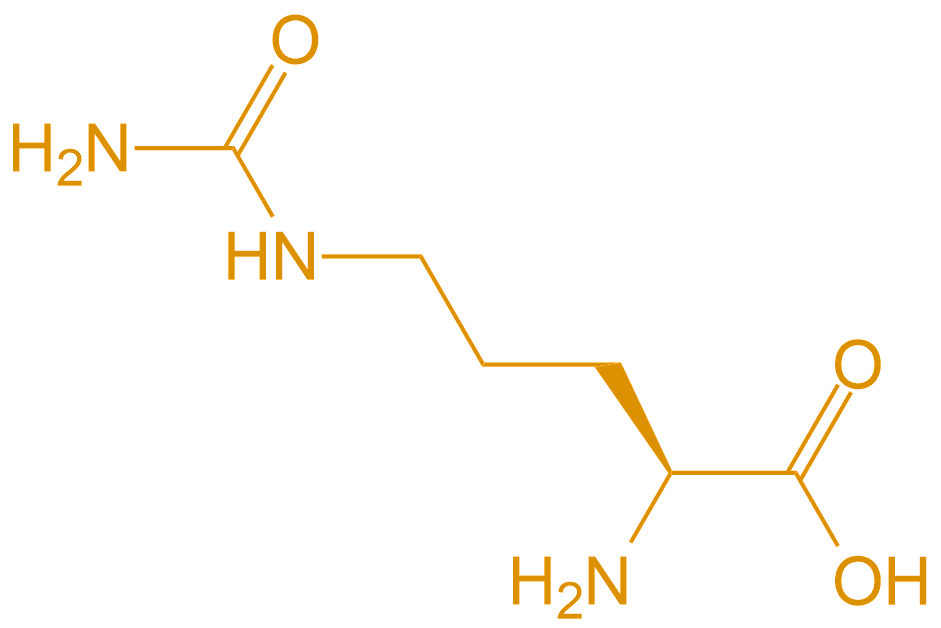 |
|
D型胍氨酸 D-Citrullin |
D-Cit | 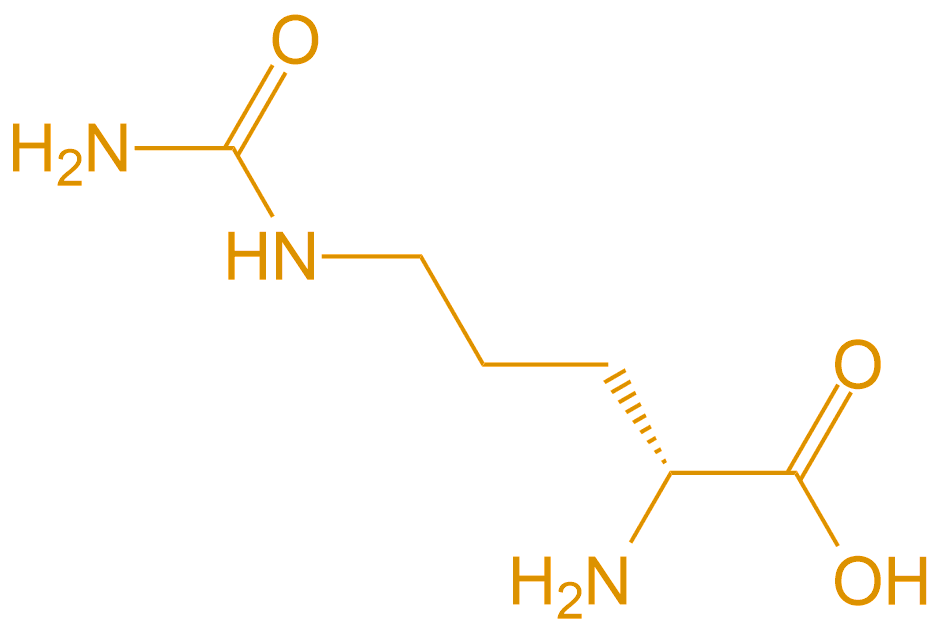 |
多聚抗原肽(Multiple-Antigen peptide, MAP)是生产高效价的抗多肽抗体和多肽疫苗的一种有效方法。
杭州专肽生物根据客户需求,帮助客户设计并且按要求定制合成各种MAP类产品,所合成的产物纯度和收率均较高。
| 多聚抗原肽分类 | 分类简写 | 结构展示 |
|---|---|---|
| 二分支 | MAPs-2 | 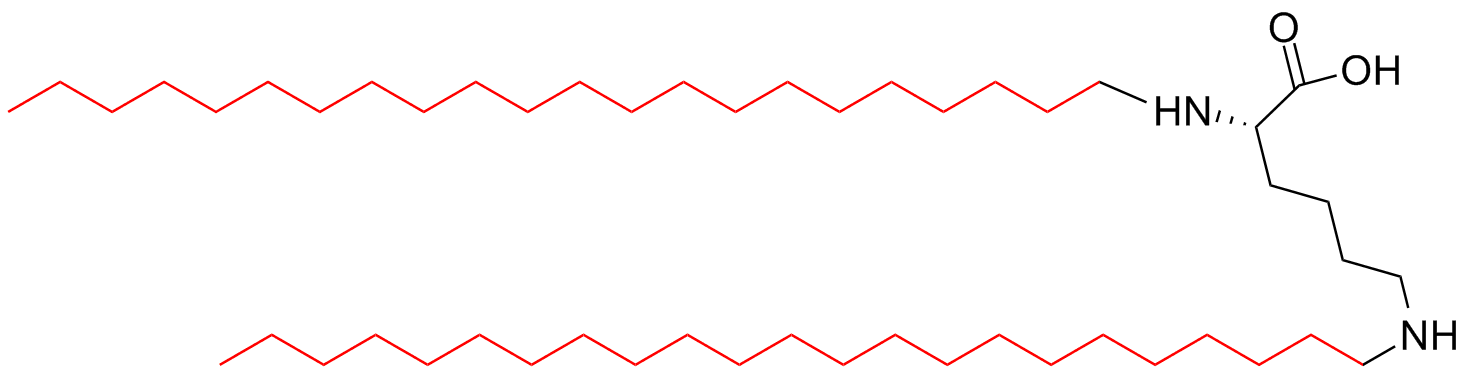 |
| 四分支 | MAPs-4 | 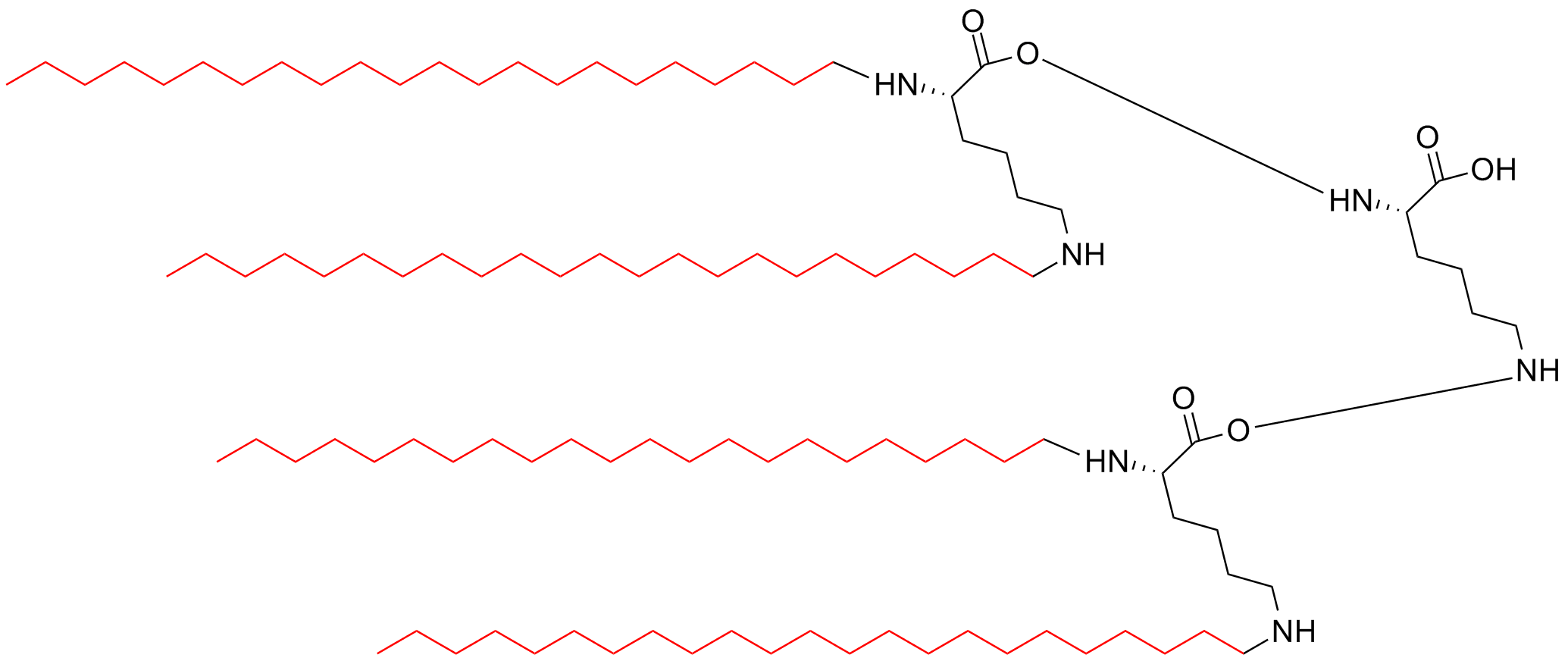 |
| 八分支 | MAPs-8 | 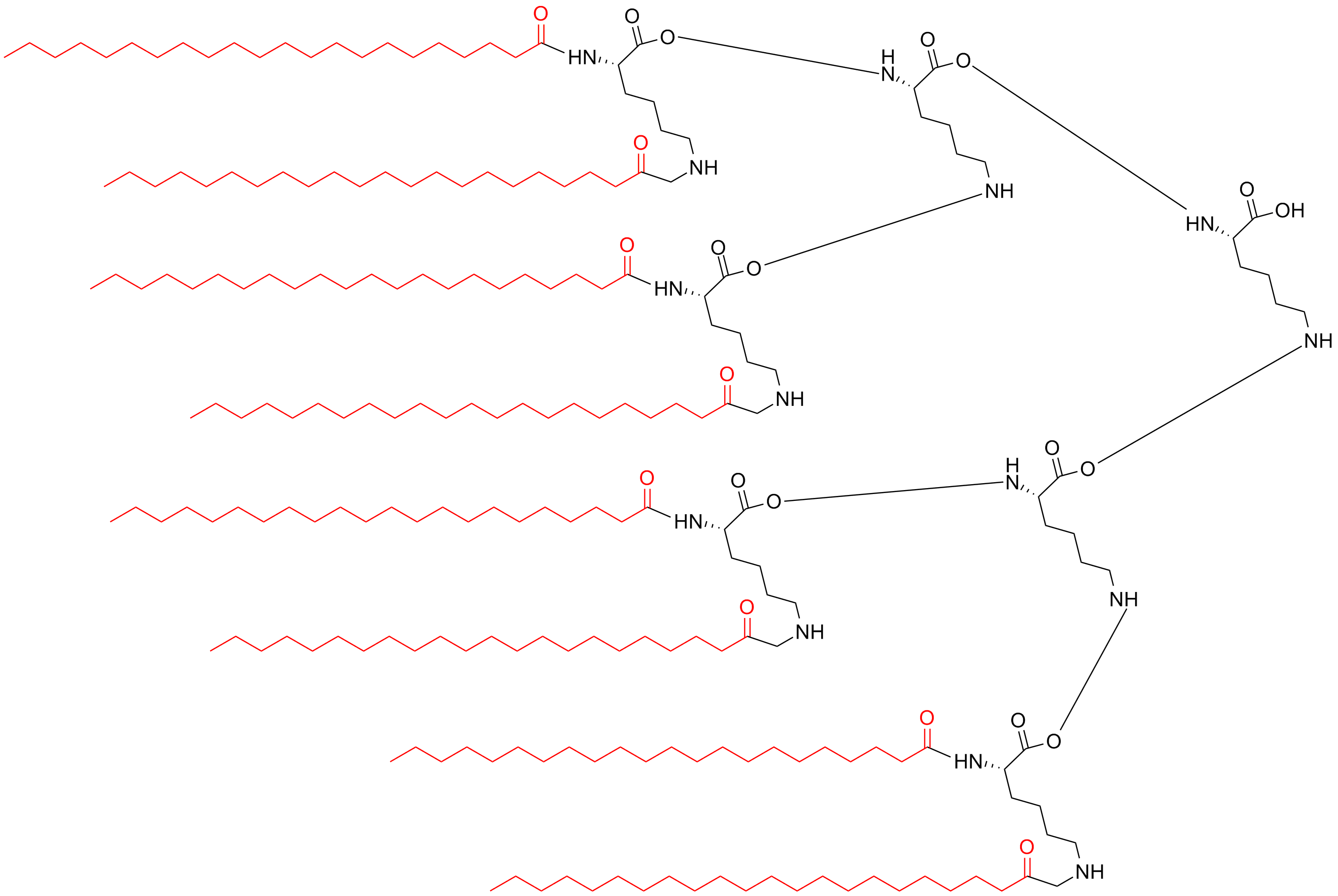 |
|
部分多聚抗原肽的结构设计问题 1,聚合度的设计,n=2-8都可以合成,n越大,合成难度也会越大。 2,支链部分的肽序列,可以不一样,常见于2分支肽的两个支链肽段。 3,序列中可以插入赖氨酸,通过赖氨酸侧链引入荧光基团(常见的5-Fam、Fitc),以达到实验检测目的。 4,对于4分支肽或者8分支肽,空间位阻因素对合成的影响就体现出来了,通常可以在支链肽段和赖氨酸的氨基之间插入 6氨基己酸,增加肽段之间的空间距离。 |
||
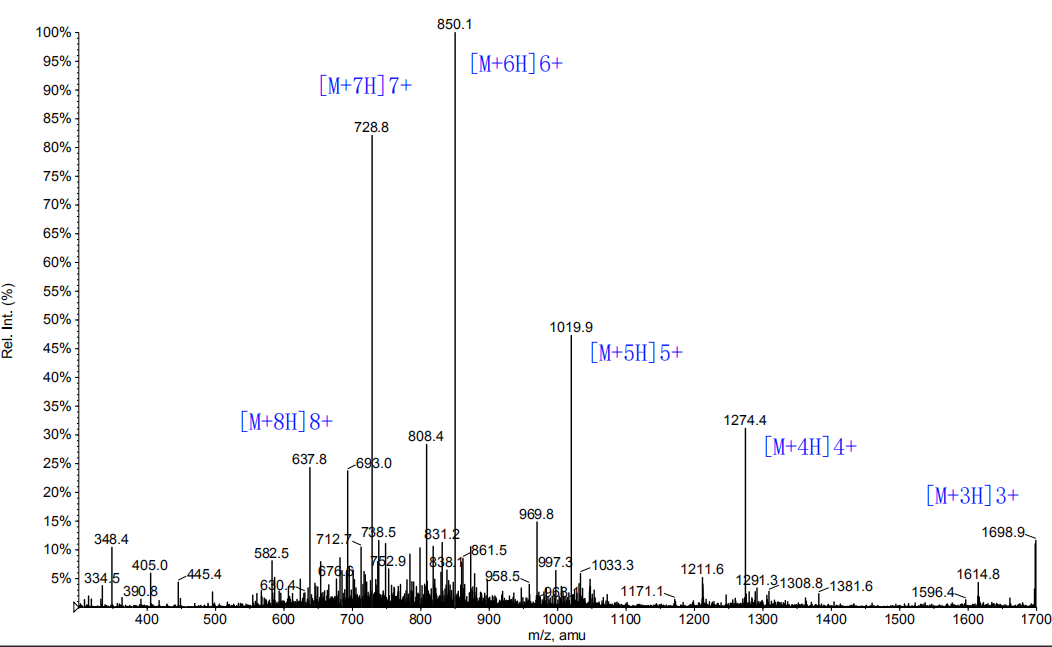
1、产品序列:{(GSVHIHIIHG)2-Lys}2-Lys-Lys(5-Fam)-OH 2四分支肽
2、产品结构:
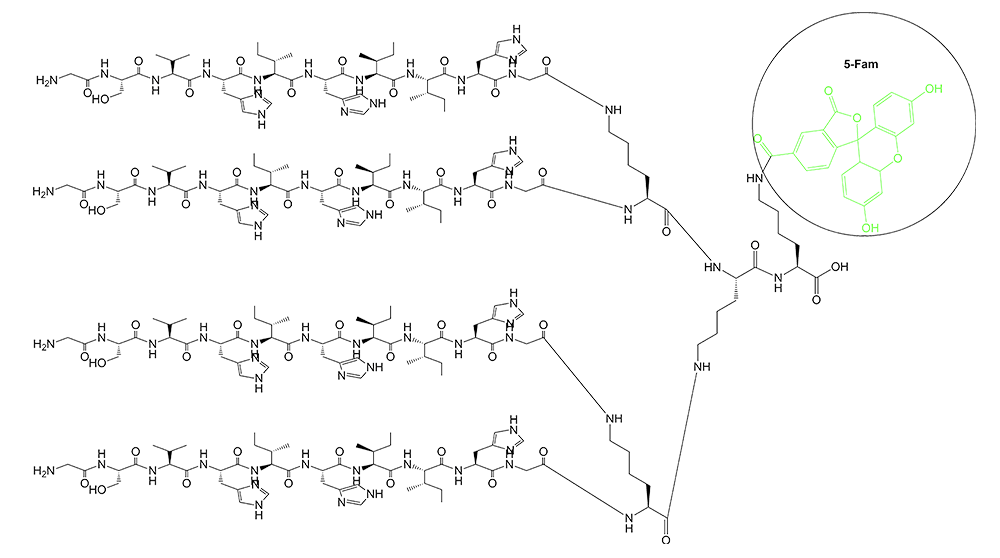
3、产品HPLC图谱
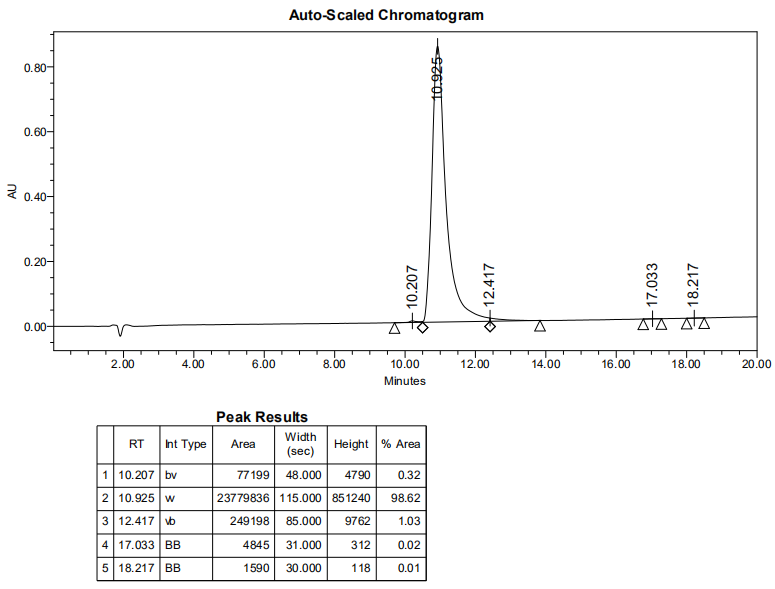
4、产品MS图谱
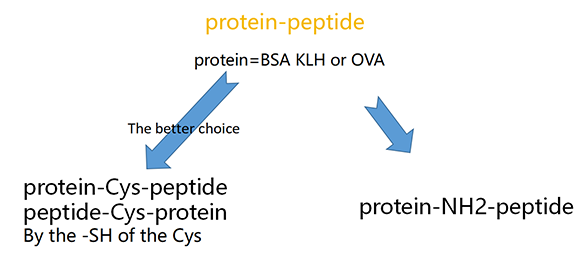
多肽载体蛋白偶联修饰用于制备抗多肽类抗体。单独的多肽通常太小不足以激起充分的免疫反应,而带有很多抗原表位的载体蛋白有利于刺激辅助性T细胞,进一步诱导B细胞免疫反应。将多肽用载体蛋白修饰后,其作为一个整体来激起免疫反应,所产生的抗体中有针对多肽的,有针对链接剂的,也有针对载体蛋白的。
最常见的载体蛋白有3种:
1)KLH (Keyhole Limpet Hemocyanin)即血蓝蛋白,它是在某些软体动物、节肢动物(蜘蛛和甲壳虫)的血淋巴中发现的一种游离的蓝色呼吸色素。血蓝蛋白含两个直接连接多肽链的铜离子,与含铁的血红蛋白类似,它易于氧结合,也易与氧解离,是已知的惟一可与氧可逆结合的铜蛋白,氧化时呈青绿色,还原时呈白色。由于KLH比BSA有更高的免疫原性,因而是最常被选用的载体蛋白。
2)BSA (Bovine Serum Albumin),即牛血清白蛋白,它属于最稳定的和可溶的白蛋白。它大约有30-35个主要氨基可用于与链接剂发生共轭反应, 使得BSA成为一种很流行的弱抗原化合物载体蛋白。BSA的不利之处在于在很多实验中,它被当作封闭剂使用,如果多肽-BSA偶联物的抗血清用于这样的检测分析中,通常会出现假阳性,因为这些血清含有抗BSA的抗体。
3)OVA (Ovalbumin),即鸡卵白蛋白。它可作为第二载体蛋白去验证抗体是否特异性地只针对多肽而并非载体蛋白(如BSA)。
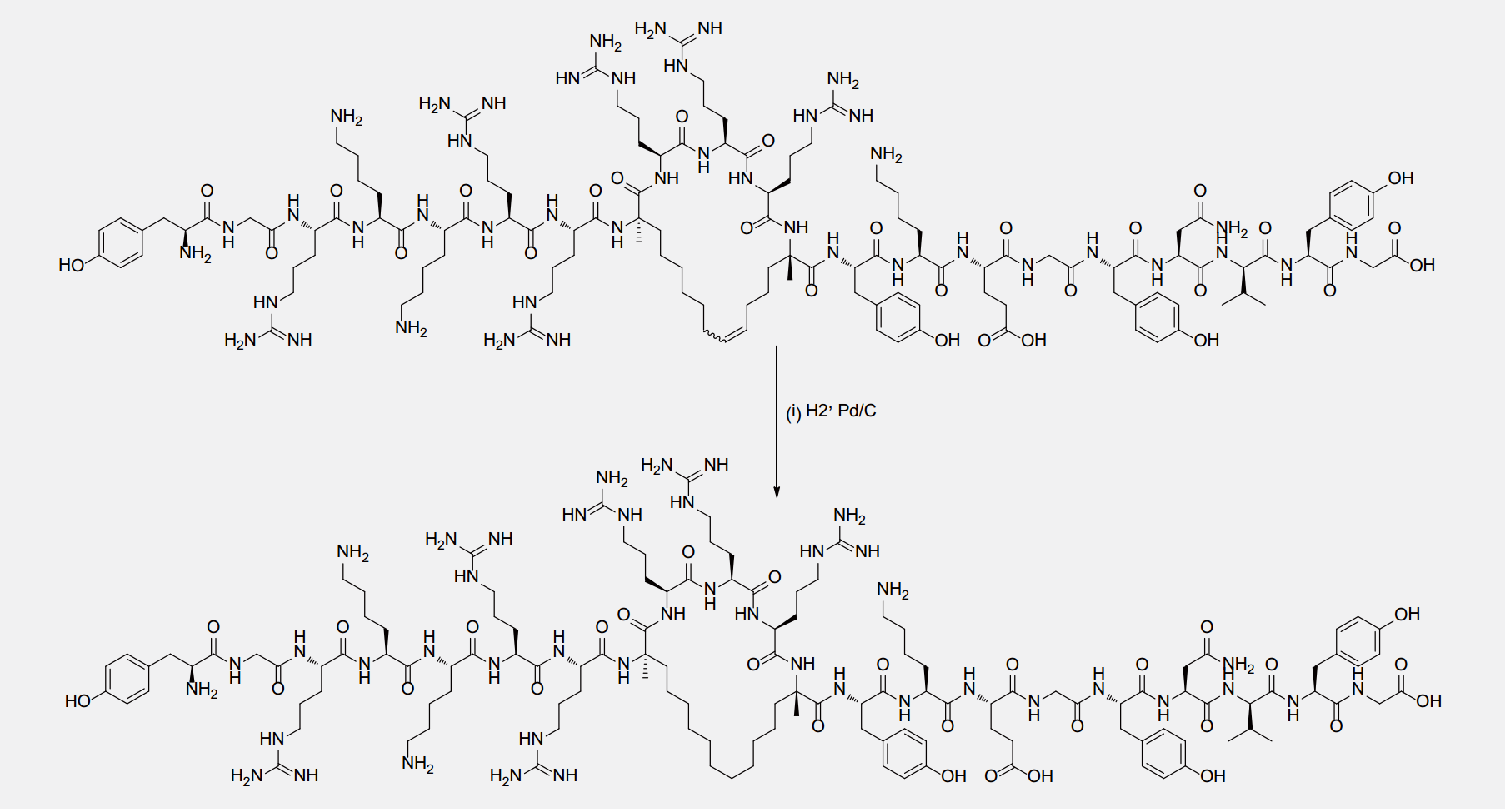
一般来说,多肽大分子发挥其生物活性和药理作用是通过其二级和三级结构来实现的。简单的线性结构多肽由于其构象比较以稳定,在发挥生物活性作用方面受到比较大的限制。针对上述问题,多肽化学家设计了Stapled Peptides,其原理是通过碳碳双键,将多肽中某一特定片段序列构象稳定下来,以满足特定的研究需求。Stapled Peptides一般采用S5和R8,中间间隔3个氨基酸,通过烯烃复分解反应来形成碳碳双键。专肽生物还可以开发其它类似的侧链含烯烃结构的特殊氨基酸,来形成其它类似的衍生物。
订书肽的合成与普通多肽合成的区别在于在固相合成肽链过程中引入两个含有α-甲基,α-烯基的非天然氨基酸,然后两个非天然氨基酸之间发生烯烃复分解反应环化构成稳定α-螺旋结构构象的全碳支架,进而合成订书肽。