400-998-5282
专注多肽 服务科研
400-998-5282
专注多肽 服务科研
SS-31肽是一种心磷脂过氧化物酶抑制剂和线粒体靶向肽。它可以改善左心室和线粒体功能。SS-31肽可减轻人小梁网状细胞中的线粒体功能障碍和氧化损伤。它可以防止iHTM和GTM(3)细胞受到H2O2诱导的持续氧化应激。治疗慢性心力衰竭和线粒体肌病的II期临床试验正在进行中。
编号:144820
CAS号:736992-21-5/1606994-55-1/1849610-71-4
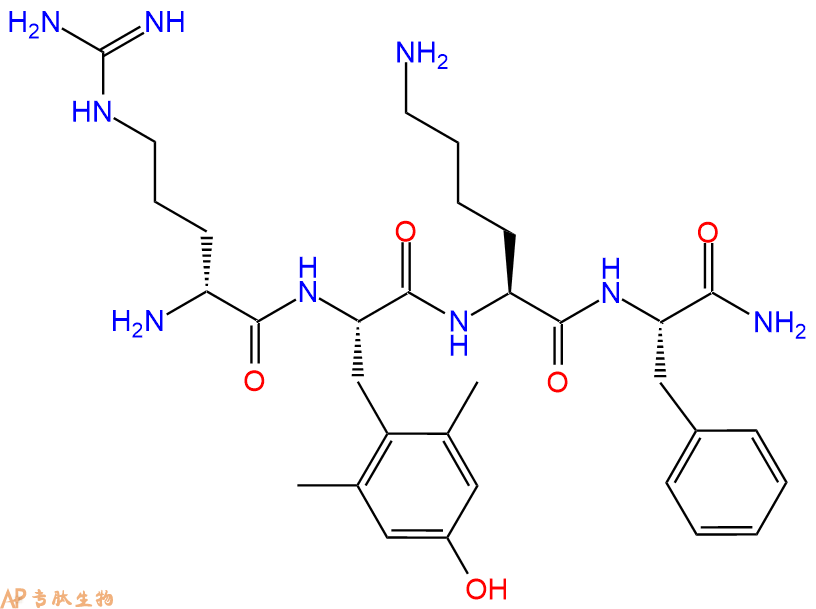
单字母:H2N-r-Dmt-KF-CONH2
| 编号: | 144820 |
| 中文名称: | 线粒体靶向抗氧化剂SS-31:DArg-Dmt-Lys-Phe-NH2/依拉瑞肽/MTP-131 |
| 英文名: | Elamipretide |
| 英文同义词: | MTP-131 |
| CAS号: | 736992-21-5,醋酸体盐 1606994-55-1,TFA盐 1849610-71-4,3醋酸分子 |
| 单字母: | H2N-r-Dmt-KF-CONH2 |
| 三字母: | H2N N端氨基:N-terminal amino group。在肽或多肽链中含有游离a-氨基的氨基酸一端。在表示氨基酸序列时,通常将N端放在肽链的左边。 -DArgD型精氨酸 -Dmt2,6-二甲基酪氨酸 -LysL-赖氨酸:lysine。系统命名为(2S)-6-二氨基已酸。是编码氨基酸中的碱性氨基酸,哺乳动物的必需氨基酸。在蛋白质中的赖氨酸可以被修饰为多种形式的衍生物。符号:K,Lys。 -PheL-苯丙氨酸:phenylalanine。系统命名为(2S)-氨基-3-苯基丙酸。是编码氨基酸。是哺乳动物的必需氨基酸。符号:F,Phe。 -CONH2C端酰胺化 |
| 氨基酸个数: | 4 |
| 分子式: | C32H49N9O5 |
| 平均分子量: | 639.79 |
| 精确分子量: | 639.39 |
| 等电点(PI): | - |
| pH=7.0时的净电荷数: | 2.97 |
| 平均亲水性: | 1.1666666666667 |
| 疏水性值: | -1.87 |
| 外观与性状: | 白色粉末状固体 |
| 消光系数: | - |
| 来源: | 人工化学合成,仅限科学研究使用,不得用于人体。 |
| 纯度: | 98% |
| 生成周期: | 现货 |
| 储存条件: | 负80℃至负20℃ |
| 标签: | 皮啡肽(Dermorphin) 氨基酸衍生物肽 靶向多肽 D型氨基酸肽 |
| InChI: | (2R)-5-amino-2-[[2-[[(2S)-6-amino-2-[[(2R)-4-amino-2-[[(2R)-2-[[(2S)-2-[[(2S)-6-amino-2-[[(2S)-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2S,3R)-2-[[(2S)-2-[[(2S,3S)-2-[[(2S)-1-[(2S)-2-[[(2S)-2-amino-3-phenylpropanoyl]amino]-3-methylbutanoyl]pyrrolidine-2-carbonyl]amino]-3-methylpentanoyl]amino]-3-phenylpropanoyl]amino]-3-hydroxybutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]acetyl]amino]-4-carboxybutanoyl]amino]-4-methylpentanoyl]amino]-5-oxopentanoyl]amino]-5-carbamimidamidopentanoyl]amino]-4-methylpentanoyl]amino]-5-oxopentanoyl]amino]-4-carboxybutanoyl]amino]hexanoyl]amino]-4-carboxybutanoyl]amino]-5-carbamimidamidopentanoyl]amino]-4-oxobutanoyl]amino]hexanoyl]amino]acetyl]amino]-5-oxopentanoic acid |
| IUPAC Name: | H-Phe-Val-Pro-Ile-Phe-Thr-Tyr-Gly-Glu-Leu-Gln-Arg-Leu-Gln-Glu-Lys-Glu-Arg-Asn-Lys-Gly-Gln-OH; L-phenylalanyl-L-valyl-L-prolyl-L-isoleucyl-L-phenylalanyl-L-threonyl-L-tyrosyl-glycyl-L-alpha-glutamyl-L-leucyl-L-glutaminyl-L-arginyl-L-leucyl-L-glutaminyl-L-alpha-glutamyl-L-lysyl-L-alpha-glutamyl-D-arginyl-D-asparagyl-L-lysyl-glycyl-D-glutamine; Motilin (swine), 13-L-leucine- |
SS-31肽是一种心磷脂过氧化物酶抑制剂和线粒体靶向肽。它可以改善左心室和线粒体功能。SS-31肽可减轻人小梁网状细胞中的线粒体功能障碍和氧化损伤。它可以防止iHTM和GTM(3)细胞受到H2O2诱导的持续氧化应激。治疗慢性心力衰竭和线粒体肌病的II期临床试验正在进行中。
H-Dmt-D-Arg-Phe-Lys-NH2 (Dmt:2,6-dimethyl-L-tyrosine) 是衍生与皮啡肽的阿片肽,它具有很强的镇痛作用和良好的细胞膜通过能力,在对其进行深入的机制研究后发现了线粒体靶向抗氧化肽SS-31 (H-D-Arg-Dmt-Lys-Phe-NH2). SS-31对缺血再灌注损伤、神经退行性疾病、心力衰竭、肌肉老化等和自由基有关的疾病具有治疗效果。SS-31 是一种针对线粒体的分子。它与心磷脂相互作用以重新激活缺血线粒体。同时SS-31也是一种细胞穿膜肽。
依拉瑞肽(MTP-131;D-Arg-DMT-Lys-Phe-NH2;其中DMT是2,6-二甲基-L-Tyr)是具有治疗缺血-再灌注损伤(例如,心脏缺血-再灌注损伤)和心肌梗塞的治疗潜力的线粒体靶向化合物。这种化合物的类似物可具有改善的治疗特征谱,包括改善的代谢性质、选择性或效力。
Elamipretide是一条由四个氨基酸组成的小分子多肽,在生物体内Elamipretide以线粒体内膜为靶点,能够预防神经细胞和其他细胞类型的氧化损伤;防止线粒体去极化,减少胰岛细胞凋亡,增加胰岛细胞产量,改善移植后功能。以Elamipretide为主要原料的药物已经进入临床三期。
Elamidetide is a small peptide composed of four amino acids, including one unnatural amino acid. In vivo, elamipretide can prevent oxidative damage of nerve cells and other cell types by targeting mitochondrial inner membrane, prevent mitochondrial depolarization, reduce apoptosis of islet cells, increase islet cell production, and improve the function after transplantation. The drugs with elamipretide as the main raw material have entered the third phase of clinical practice.
Elamipretide triacetate是一种芳香阳离子四肽,靶向线粒体内膜,是心磷脂过氧化物酶的抑制剂。它很容易穿透细胞膜,并已用于研究Leber遗传性视神经病变的治疗试验。
Elamipretide triacetate is an aromatic-cationic tetrapeptide that targets the mitochondrial intima and is an inhibitor of cardiolipin peroxidase. It easily penetrates cell membranes and has been used in therapeutic trials investigating Leber's Hereditary Optic Neuropathy.
皮啡肽(Dermorphin)的定义
在属于Phyllomedusinae亚科的南美蛙类皮肤中发现了一组阿片肽。从这些蛙类的几个物种中分离出的第一种肽是dermorphin,该肽对µ型阿片受体表现出高亲和力和高选择性【1】。
A group of opioid peptides has been discovered in the skin of South American frogs belonging to the subfamily Phyllomedusinae. The first peptide isolated from several species of these frogs was dermorphin which was shown to have high affinity and selectivity for µ-type opioid receptors 【1】.
皮啡肽(Dermorphin)的相关多肽
在发现dermorphins后,研究人员随后从双色叶尾蜥的皮肤中分离出了另外两种对δ受体亲和力更高的肽。与dermorphins类似,这些肽的第二位氨基酸也是D-丙氨酸,因此被命名为[D-Ala2]deltorphins I和II 【1】。Dermorphins和deltorphins都是七肽,其共同的氨基端序列为Tyr-D-Ala-Phe【2】。
After the discovery of dermorphins, two additional peptides with even higher affinity for the d receptor were subsequently isolated from the skin of Phyllomedusa bicolor. Like dermorphin, these peptides contain D-alanine as the second amino acid and they have been termed [D-Ala2] deltorphins I and II 【1】. Dermorphins and deltorphins are heptapeptides with the common amino terminal sequence Tyr-D-Ala-Phe 【2】.
皮啡肽(Dermorphin)的发现
1981年,Montecucchi等人从阿根廷青蛙Phyllomedusa sauvagei的皮肤中提取了一种名为dermorphin的七肽,该七肽优先结合µ型阿片受体。Erspamer等人于1989年报道了从P. sauvagei的皮肤中分离出deltorphins【2】。
In 1981, Montecucchi et al., extracted from the skin of the Argentinian frog Phyllomedusa sauvagei a heptapeptide named dermorphin, which preferentially binds to µ-type opioid receptors. Erspamer et al., in 1989 reported the isolation of deltorphins from the skin of P. sauvagei 【2】.
皮啡肽(Dermorphin)的结构特征
这些是具有共同氨基末端序列Tyr-D-Ala-Phe的七肽。由于这一初始序列是保守的,因此推测它对于与阿片受体的µ和d位点结合是必需的。与地吗啡不同,地吗啡肽在位置4上有一个带电氨基酸,在地吗啡的情况下是组氨酸,在[D-Ala2]-地吗啡的情况下是天冬氨酸或谷氨酸。该位置上带正电或负电氨基酸的存在对结合特性几乎没有影响。因此,地吗啡肽C末端区域的其他特征很可能对观察到的受体选择性至关重要。地吗啡肽是灵活的线性肽。它们对d位点的亲和力比合成脑啡肽类似物2高10至200倍。地吗啡肽含有氨基末端序列Tyr-Ala-Phe,该序列前有一个典型的前激素加工信号Lys-Arg。地吗啡肽序列之后是更复杂的加工序列Gly-Glu-Ala-Lys-Lys,其中甘氨酸是形成羧基末端酰胺所必需的。在来自Ph. sauvagei的地吗啡前体中也发现了相同的侧翼序列【1】。
These are heptapeptides with the common aminoterminal sequence Tyr-D-Ala-Phe. Since this initial sequence is conserved, it is presumed that it is necessary for binding to both µ and d sites of opioid receptors. Unlike dermorphin, the deltorphins have a charged amino acid in position 【4】, namely histidine in the case of deltorphin and aspartic or glutamic acid in the case of [D-Ala2]-deltorphins. The presence of positively or negatively charged amino acids in this position has little influence on the binding characteristics. It thus seems likely that other features in the C-terminal regions of deltorphins are essential for the observed receptor selectivity. Deltorphins are flexible linear peptides. They show an affinity for d sites 10 to 200 times higher than that of the synthetic enkephalin analogue 【2】. Deltorphins contain the amino terminal sequence Tyr-Ala-Phe, which is preceded by the typical prohormone processing signal Lys-Arg. Following the deltorphin sequence is the more complex processing sequence Gly-Glu-Ala-Lys-Lys, the glycine being required for the formation of the carboxyl-terminal amide. The same flanking sequences have also been found in the dermorphin precursors from Ph. sauvagei 【1】.
类似物:D-丙氨酸2,谷氨酸4] - 和 [D-丙氨酸2,天冬氨酸4] 德尔托啡酰胺,其L异构体,以及1-(3,5-二碘酪氨酰基)[D-丙氨酸2] 德尔托啡是采用固相合成法制备的德尔托啡的合成类似物【2】。
Analogs: D-Ala2, Glu4] - and [D-Ala2, Asp4] deltorphinamides, their L isomers, and 1-(3, 5-diiodotyrosyl) [D-Ala2] deltorphins are synthetic analogs of deltorphins prepared by solid-phase synthesis 【2】.
地吗啡类似物,包括[Lys7-NH2]地吗啡、[Arg7-NH2]地吗啡和[Asn7-NH2]地吗啡,均表现出强效的镇痛作用。[Lys7-NH2]地吗啡的镇痛效果持续时间比地吗啡本身更长【3】。
Dermorphin analogs, [Lys7-NH2] dermorphin, [Arg7-NH2] dermorphin, and [Asn7-NH2] dermorphin behave as potent analgesic agents. The antinociception effect of [Lys7-NH2] dermorphin lasts longer than that of dermorphin itself 【3】.
在另一项研究中,分析了在冷(4–7°C)、热中性(27–28°C)和热(31–33°C)环境下,以0.5 mg/kg剂量腹腔注射经立体化学修饰的dermorphin类似物(Tyr-D-Ala-Phe-Gly-Tyr-Hyp-Ser-NH2、Tyr-D-Ala-Phe-Gly-Tyr-[D-Pro]-Ser-NH2、Tyr-D-Ala-Phe-Gly-Tyr-[dehydro-Pro]-Ser-NH2和Tyr-D-Ala-Phe-Gly-Tyr-[D-dehydro-Pro]-Ser-NH2)的影响。氨基酸残基脯氨酸(位置6,Pro6)的立体化学修饰被证明会诱导肽的体温调节效应发生特定变化。用DPro6替代Pro6会产生最显著的结果:在冷环境下,它显著减弱了dermorphin的体温调节效应;在热环境下,则完全抵消了dermorphin的体温调节效应;在热中性条件下,则逆转了dermorphin特有的体温调节反应。由此获得的数据表明,Pro6残基在实现dermorphin的这种生理活性中起着重要作用[4]。
In another study, the influence of dermorphin analogs with stereochemical modification of the amino acid residue proline in position 6 (Pro6), Tyr-D-Ala-Phe-Gly-Tyr-Hyp-Ser-NH2, Tyr-D-Ala-Phe-Gly-Tyr-[D-Pro]-Ser-NH2, Tyr-D-Ala-Phe-Gly-Tyr-[dehydro-Pro]-Ser-NH2, and Tyr-D-Ala-Phe-Gly-Tyr-[D-dehydro-Pro]-Ser-NH2, was analysed after their intraperitoneal injection at 0.5 mg/kg dose in the cold (4–7°C), thermoneutral (27–28°C), and hot (31–33°C) environment. Stereochemical modifications of amino acid residue Pro6 proved to induce specific changes in the thermoregulatory effect of the peptide. Substitution of DPro6 for Pro6 has the most dramatic consequences: it considerably attenuated the thermoregulatory effect of dermorphin in the cold environment, cancelled it in the hot environment, and inverted the dermorphin-specific thermoregulatory response in thermoneutral conditions. The data thus obtained indicate the important role of Pro6 residue in realization of this physiological activity of dermorphins 【4】.
皮啡肽(Dermorphin)的作用方式
皮肤素和德尔托啡分别对µ型和d型阿片受体具有高亲和力和高选择性【2】。
Dermorphin and deltorphins have high affinity and selectivity for µ- and d-type opioid receptors, respectively 【2】.
皮啡肽(Dermorphin)的功能
在啮齿动物和灵长类动物(包括人类)中,δ-内啡肽是一类强效镇痛剂。部分δ-内啡肽可进入血脑屏障,并在外周给药后产生中枢镇痛作用。δ-内啡肽家族还包括μ1-阿片受体选择性激动剂,这些激动剂能产生强烈的阿片类镇痛作用,但会刺激肺通气。对长期暴露于δ-内啡肽的大鼠和小鼠进行的实验表明,它们不仅具有比吗啡更高的镇痛效果和效力,而且与吗啡相比,产生耐受性、依赖性和阿片类药物副作用的可能性更低【5】。[3H][D-Ala2]δ-内啡肽I是结合研究中有价值的探针,因为其亲和力和选择性是迄今为止已知的所有δ-选择性配体中最高的[2]。
Dermorphin peptides are potent analgesics in rodents and primates, including man. Some dermorphins can enter the blood-brain barrier and produce central antinociception after peripheral administration. The dermorphin family also includes µ 1-opioid receptor selective agonists that produce intense opioid analgesia, but stimulate pulmonary ventilation. Experiments in rats and mice chronically exposed to dermorphins have shown that not only do they have higher antinociceptive efficacy and potency than morphine, but they are also less likely than morphine to produce tolerance, dependence and opiate side effects 【5】. [3H][D-Ala2] deltorphin I is a valuable probe for binding studies, since its affinity and selectivity are the highest of all the d -selective ligands known to date 【2】.
皮啡肽(Dermorphin)的相关文献
1. K Richter K, R Egger R, L Negri L, R Corsi R, C Severini C, Kreil G (1990). cDNAs encoding [D-Ala2]deltorphin precursors from skin of Phyllomedusa bicolor also contain genetic information for three dermorphin-related opioid peptides (amphibian skin peptides / precursors). PNAS., 87(12)4836-4839.
2. Erspamer V, Melchiorri P, Falconieri-Erspamer G, Negri L, Corsi R, Severini C, Barra D, Simmaco M Kreil G (1989). Deltorphins: A family of naturally occurring peptides with high affinity and selectivity for d opioid binding sites (amphibian skin peptides/mouse vas deferens assay/receptor binding assay). PNAS., 86:188-5192.
3. Negri L, Erspamer GF, Severini C, Potenza RL, Melchiorri P, Erspamer V (1992). Dermorphin-related peptides from the skin of Phyllomedusa bicolor and their amidated analogs activate two µ opioid receptor subtypes that modulate antinociception and catalepsy in the rat. PNAS., 89:7203-7207.
4. Emel’yanova TG, Usenko AB, Bonartsev AP, Kamenskii AA, Guzevatykh LS, Andreeva LA, Alfeeva L, Myasoedov NF (2002). Effect of Dermorphin Analogs on Thermoregulation of Rats under Various Thermal Conditions. Biology Bulletin, 29(3):284–289.
5. Melchiorri P, Negri L. (1996). The dermorphin peptide family. Gen Pharmacol., 27(7):1099-1107.
靶向多肽可以根据其功能和用途分为不同的类别。在PDC(多肽偶联药物)中,靶向多肽通常被分为细胞穿透肽和细胞靶向肽两大类。
细胞穿透肽:这类多肽能够跨越细胞膜,转运具有生物活性的大分子物质,如多肽、蛋白质、核酸等化学药物,使其顺利进入细胞。一些常见的细胞穿透肽包括Pep-1、Pentratin、PepFact14、Transportan等。
细胞靶向肽:这类多肽的作用主要是引导化学药物或生物活性分子与特定类型的细胞结合,以提高其靶向性和治疗效率。常见的细胞靶向肽包括PEGA、生长激素抑制素类似物、蛙皮素类似物、RGD肽类等。
很多蛋白在细胞中非常容易被降解,或被标记,进而被选择性地破坏。但含有部分D型氨基酸的多肽则显示了很强的抵抗蛋白酶降解能力。
| DOI | 名称 | |
|---|---|---|
| 10.1111/cbdd.12003 | Superior Analgesic Effect of H-Dmt-D-Arg-Phe-Lys-NH2 ([Dmt1]DALDA), a Multifunctional Opioid Peptide, Compared to Morphine in a Rat Model of Neuropathic Pain | 下载 |
| 10.1111_1440-1681.13484 | SS-31 protect retinal pigment epithelial cells from H2O2- induced cell injury by reducing apoptosis | 下载 |
| 10.1111_acel.13213 | SS-31 and NMN: Two paths to improve metabolism and function in aged hearts | 下载 |
| 10.1111_acel.12731 | Treatment with the mitochondrial-targeted antioxidant peptide SS-31 rescues neurovascular coupling responses and cerebrovascular endothelial function and improves cognition in aged mice | 下载 |
| 10.1111_bph.12468 | Targeting mitochondrial cardiolipin and the cytochrome c/cardiolipin complex to promote electron transport and optimize mitochondrial ATP synthesis | 下载 |
| 10.1155/2022/1295509 | SS-31, a Mitochondria-Targeting Peptide, Ameliorates Kidney Disease | 下载 |
| 10.1161/CIRCHEARTFAILURE.115.002206 | Chronic Therapy With Elamipretide (MTP-131), a Novel Mitochondria-Targeting Peptide, Improves Left Ventricular and Mitochondrial Function in Dogs With Advanced Heart Failure | 下载 |
| 编号 | 名称 | CAS号 |
| 432781 | Cys-SS-31 | |
| H2N-Cr-Dmt-KF-CONH2 | ||
| SS-31的N端添加半胱氨酸,引入巯基 | ||





