编号:151894
CAS号:131256-74-1
单字母:H2N-YPSKPDNPGEDAPAEDMARY-(NMe)Y-SALRHYINLITRQRY-NH2
| 编号: | 151894 |
| 中文名称: | 神经肽Y (Tyr(NMe)21)-Neuro Peptide Y (human, rat) |
| 英文名: | (Tyr(NMe)21)-Neuro Peptide Y(human, rat) |
| CAS号: | 131256-74-1 |
| 单字母: | H2N-YPSKPDNPGEDAPAEDMARY-(NMe)Y-SALRHYINLITRQRY-NH2 |
| 三字母: | H2N N端氨基 -Tyr酪氨酸 -Pro脯氨酸 -Ser丝氨酸 -Lys赖氨酸 -Pro脯氨酸 -Asp天冬氨酸 -Asn天冬酰胺 -Pro脯氨酸 -Gly甘氨酸 -Glu谷氨酸 -Asp天冬氨酸 -Ala丙氨酸 -Pro脯氨酸 -Ala丙氨酸 -Glu谷氨酸 -Asp天冬氨酸 -Met甲硫氨酸 -Ala丙氨酸 -Arg精氨酸 -Tyr酪氨酸 -(NMe)TyrN甲基化酪氨酸 -Ser丝氨酸 -Ala丙氨酸 -Leu亮氨酸 -Arg精氨酸 -His组氨酸 -Tyr酪氨酸 -Ile异亮氨酸 -Asn天冬酰胺 -Leu亮氨酸 -Ile异亮氨酸 -Thr苏氨酸 -Arg精氨酸 -Gln谷氨酰胺 -Arg精氨酸 -Tyr酪氨酸 -NH2C端酰胺化 |
| 氨基酸个数: | 36 |
| 分子式: | C190H287N55O57S1 |
| 平均分子量: | 4285.71 |
| 精确分子量: | 4283.1 |
| 等电点(PI): | 10.85 |
| pH=7.0时的净电荷数: | 5.21 |
| 平均亲水性: | 0.20666666666667 |
| 疏水性值: | -1.15 |
| 外观与性状: | 白色粉末状固体 |
| 消光系数: | 7450 |
| 来源: | 人工化学合成,仅限科学研究使用,不得用于人体。 |
| 纯度: | 95%、98% |
| 盐体系: | 可选TFA、HAc、HCl或其它 |
| 生成周期: | 2-3周 |
| 储存条件: | 负80℃至负20℃ |
| 标签: | 甲基化修饰肽 神经肽及相关肽 |
甲基化修饰多肽
也叫甲基化标记多肽,甲基化修饰是蛋白质翻译后修饰(PTMs)的一种,几乎参与细胞所有的生命活动过程,发挥着重要的调控作用,蛋白质在甲基转移酶的催化下将甲基转移至特定的氨基酸残基上共价结合的过程。甲基化是一种可逆的修饰过程,由去甲基化酶催化去甲基化作用。
研究发现,常见甲基化/去甲基化作用的氨基酸主要是赖氨酸(Lys)和精氨酸(Arg)研究表明,组蛋白赖氨酸甲基化修饰执行着多种生物学功能,如干细胞的维持和分化、X染色体失活、转录调节和DNA损伤反应等,主要是影响染色质浓缩,抑制基因表达。组蛋白精氨酸甲基化在基因转录调控中发挥着重要作用,并能影响细胞的多种生理过程,包括DNA修复、信号转导、细胞发育及癌症发生等因此专肽生物特地开发甲基化修饰多肽技术,为科学家在蛋白质翻译后修饰(PTMS)的研究中提供帮助。
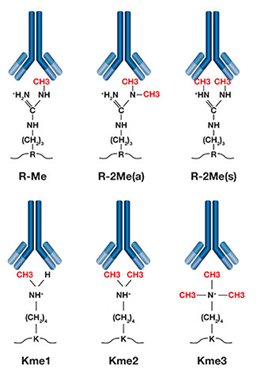
甲基化修饰(Me1,Me2,Me3)
采用高品质的Fmoc-Lys(Me,Boc)-OH、 Fmoc-Lys(Me2)-OH、Fmoc-Lys(Me3)-OH.HCL、Fmoc-Arg(Me,Pbf)-OH 、Fmoc-Arg(me)2-OH.HCl(asymmetrical) 、Fmoc-Arg(me)2-OH.HCl(symmetrical) 等原料,采用Fmoc固相合成工艺合成,得到Lys甲基化,Arg甲基化标记的多肽,使用HPLC 对产物进行纯化。最终产品提供相应的质谱图,纯度分析的HPLC 色谱图。
定义
神经肽的长度为3-40个氨基酸,可作为神经递质。它们广泛分布于中枢神经系统和周围神经系统。
发现
神经肽是由约翰·休斯博士和科斯特里茨博士于1975年发现的。它们是内啡肽,内在产生的吗啡样物质,会在体内产生一系列类似药物的作用。可以从序列信息1中鉴定神经肽前体mRNA序列,并且得到的翻译蛋白序列包括信号肽序列和一个或多个神经肽。广泛而复杂的一系列酶处理步骤,包括被激素或前蛋白转化酶切割以及其他翻译后修饰,在创建活性神经肽之前就发生在翻译后的蛋白质序列上 2,3。
结构特征
通过核磁共振(NMR)光谱研究了几种来自软体动物的类似神经肽的构象性质。肽的N末端可变区中的氨基酸取代对溶液中反向转化的种群具有显着影响。通过使用两个独立的NMR参数测得的转弯数,发现使用Helix aspersa的受体膜制剂与IC50值高度相关(r2 = 0.93和0.82)。这些结果表明,构象集合降低了特定肽相对于特定受体4,5的有效浓度。
神经肽Y与人肽相同,并且与禽胰多肽高度同源。神经肽Y和禽胰多肽之间的同源性保留了维持三级结构必不可少的所有残基。结果表明,神经肽保留了紧凑的三级结构,其特征是在N末端的聚脯氨酸II类螺旋和C末端的a螺旋 6之间广泛的疏水相互作用。
已经通过许多孤儿受体之一发现了一些肽,这些受体是内源性配体未知的受体,例如“类阿片受体样1”(ORL1)。随后,已阐明该ORL1受体的内源性激动剂的结构,一种称为孤儿蛋白FQ或伤害感受蛋白的17个氨基酸的肽7。
行动方式
神经肽是由神经元作为细胞间信使释放的肽。一些神经肽充当神经递质,而另一些充当激素。神经肽既可以为我们提供支持,也可以为我们提供帮助。抗炎神经肽可帮助我们减少皮肤发炎。神经肽是自然产生的,可以在非常有限的时间内与靶细胞膜受体在明确的作用位点相互作用。因此,大多数这些内源性化合物的特征在于低的生物屏障渗透性和非常高的酶促降解敏感性。脑室内或全身注射神经肽Y(NPY)可使cast割的雌性大鼠血浆中的促黄体生成激素(LH)水平降低。6。
功能
生物功能,神经肽控制着我们的情绪,能量水平,痛苦和愉悦感,体重以及解决问题的能力;它们还会形成记忆,情感行为,食欲和发炎,修复疤痕和皱纹并调节我们的免疫系统。这些活跃的大脑小信使实际上打开了皮肤7的细胞功能。因此,今天,与神经肽系统相互作用的药物设计是后基因组药物化学研究最广泛的途径之一。
P物质已被确定为负责伤害性信号传递的主要神经肽。内源性阿片类药物是天然神经肽,负责伤害性信号的调节(通常是抑制)。
免疫系统,当它们被分泌时,它们会激活自然杀伤细胞(NK细胞),从而增强我们的免疫系统。
随着内啡肽的分泌越来越多,血管病变使收缩的血管恢复到正常状态,使血液以正常方式流动。大多数成人疾病都始于血管堵塞。内啡肽有助于改善血液循环。
内啡肽通过去除超氧化物具有抗衰老作用。从呼吸进入人体的氧气可以转变为超氧化物。这是造成人类疾病和衰老的最大敌人之一。
抗压力激素,应对压力的能力与我们体内的内啡肽水平成正比。
缓解疼痛的作用是,我们的神经系统在接收到疼痛信号时会分泌神经递质。一旦内啡肽在疼痛的那一刻被释放,内啡肽就会与神经元上的内啡肽受体结合,从而阻止第一种神经递质被分泌出来。
记忆力,神经肽可以改善记忆力,因为它们可以使脑细胞保持年轻健康。
参考
1. Hummon AB, Richmond TA, Verleyen P, Baggerman G, Huybrechts J, Ewing MA, Vierstraete E, Rodriguez-Zas SL, Liliane SL, Robinson GE (2006). From the genome to the proteome: uncovering peptides in the Apis brain. Science, 27(314):647-649.
2. Rockwell NC, Krysan DJ, Komiyama T, Fuller RS (2002). Precursor processing by Kex2/Furin Proteases. Chem. Rev., 102:4525–4548.
3. Von ER, Beck-Sickinger AG (2004). Biosynthesis of peptide hormones derived from precursor sequences. Curr. Med. Chem.,11:2651–2665.
4. Edison AS, Espinoza E, Zachariah C (1999). Conformational Ensembles: The Role of Neuropeptide Structures in Receptor Binding. The Journal of Neuroscience., 19(15):6318-6326.
5. Payza K, Greenberg MJ, Price DA (1989). Further characterization of Helix FMRFamide receptors: kinetics, tissue distribution, and interactions with the endogenous heptapeptides. Peptides, 10:657-661.
6. Allen J, Novotný J, Martin J, Heinrich G (1987). Molecular structure of mammalian neuropeptide Y: Analysis by molecular cloning and computer-aided comparison with crystal structure of avian homologue. PNAS., 84:2532-2536.
7. Guya J, Lia S, Pelletier G (1988). Studies on the physiological role and mechanism of action of neuropeptide Y in the regulation of luteinizing hormone secretion in the rat. Regulatory Peptides., 23(2):209-216.





