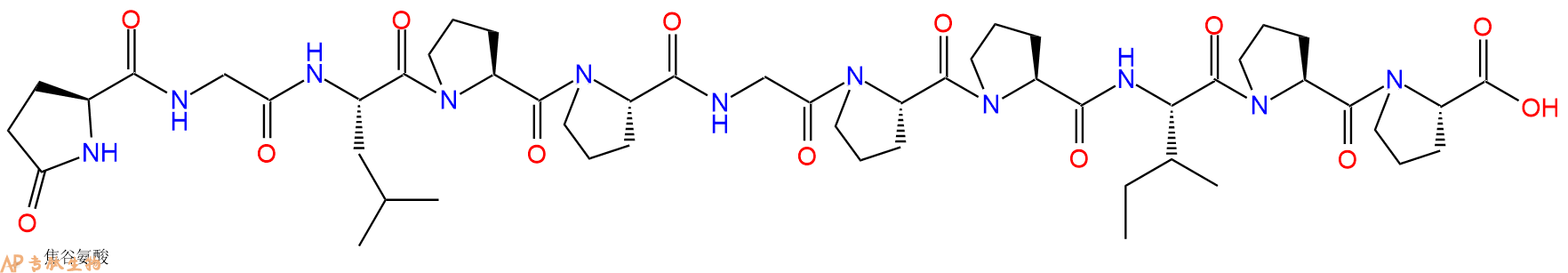
编号:140179
CAS号:30953-20-9
单字母:Pyr-GLPPGPPIPP-OH
| 编号: | 140179 |
| 中文名称: | Bradykinin Potentiator 、Angiotensin I Converting Enzyme Inhibitor |
| 英文名: | Bradykinin Potentiator 、Angiotensin I Converting Enzyme Inhibitor |
| CAS号: | 30953-20-9 |
| 单字母: | Pyr-GLPPGPPIPP-OH |
| 三字母: | Pyr 焦谷氨酸 -Gly甘氨酸 -Leu亮氨酸 -Pro脯氨酸 -Pro脯氨酸 -Gly甘氨酸 -Pro脯氨酸 -Pro脯氨酸 -Ile异亮氨酸 -Pro脯氨酸 -Pro脯氨酸 -OHC端羧基 |
| 氨基酸个数: | 10 |
| 分子式: | C51H77N11O13 |
| 平均分子量: | 1052.22 |
| 精确分子量: | 1051.57 |
| 等电点(PI): | - |
| pH=7.0时的净电荷数: | - |
| 平均亲水性: | -1.8 |
| 疏水性值: | -0.21 |
| 外观与性状: | 白色粉末状固体 |
| 消光系数: | - |
| 来源: | 人工化学合成,仅限科学研究使用,不得用于人体。 |
| 纯度: | 95%、98% |
| 盐体系: | 可选TFA、HAc、HCl或其它 |
| 生成周期: | 2-3周 |
| 储存条件: | 负80℃至负20℃ |
| 标签: | 血管紧张素(Angiotensin) 缓激肽(Bradykinin) |
定义
血管生成素(ANG),一种14,124 Da的蛋白质,与肿瘤进展中的血管生成有关。它由肿瘤细胞分泌,肿瘤细胞是新生血管形成的有效诱导剂1。同时血管生成素可引起血管收缩并促使血压升高。它是肾素-血管紧张素系统的一部分,这是降低血压的药物的主要靶标。血管紧张素(ANG)是血管紧张素原(AGT)在肾素和一系列酶的作用下形成的一组寡肽激素。
血管紧张素是一种肽类激素,引起血管收缩及随后血压升高。血管紧张素是一种寡肽类激素,具有强大的致渴作用。它是由前体分子血管紧张素原生成的,血管紧张素原是肝脏中产生的血清球蛋白。血管紧张素在肾素-血管紧张素系统中起重要作用(1)。肾素作用于血管紧张素原,产生血管紧张素I。在肾小球旁细胞中,当肾交感神经兴奋、肾内血压降低或运送到致密斑的Na+和Cl-离子降低,致密斑感受到较少的Na+时,肾小球旁细胞释放的肾素增加。肾素裂解血管紧张素原中亮氨酸(Leu)和缬氨酸(Val)之间的肽键,生成含有十个氨基酸的多肽(DES-ASP),即血管紧张素I,血管紧张素I似乎没有任何的生物活性,仅仅是作为血管紧张素II的前体。
发现
1885年,Fett等人首先从由HT-29人结肠腺癌细胞1调节的培养基中分离血管生成素,然后从正常哺乳动物的血浆2和牛奶中分离出血管生成素。随后已从人,牛,兔,猪和小鼠的血清和牛乳中分离出它。血管生成素具有核糖核酸分解活性,与胰腺RNAse A 具有33%的序列同源性。合成肽'H-Glu-Asn-Gly-Leu-Pro-Val-His-Leu-Asp-Gln-Ser-Ile-Phe-Arg-Arg-OH(108-122)对应于ANG抑制血管生成素的酶和生物活性。几种C末端合成肽,包括(Ang 108-123),可显着降低血管生成素诱导的新血管形成。
结构特点
Acharya等人在2.4 0 A时确定了人类抗原的晶体结构。总体结构具有肾形三级褶皱,让人联想到RNaseA。核糖核酸裂解活性中心(His-13,His-114和Lys-40)和假定的受体结合位点,这两个关键参与生物学功能是不同于Rnase A 。 分子的中心核心由带有一对反平行扭曲的P结构组成,形成了主拓扑,顶点处有残基Ser-72和Gly-99。在这些中央链的任一侧的两个附加链(残基41-47; 111-116)完成了主要的片状结构。结构中存在3个螺旋H1,残基3-14,H2,残基22-33和H3,残基49-58。
作用机理
ANG四个方面已经发现,是必要的ANG诱导的血管生成的过程中,ANG发挥其核糖核酸活动- ANG有一个非常弱的10 5 - 10 6比核糖核酸酶答:这更低的核糖核酸活动,因为嘧啶结合谷氨酰胺(Gln)117残基“阻碍”了ANG的位点。然而,ANG的核糖核酸分解活性对于血管生成至关重要。ANG提神基底膜降解- ANG结合到一个上肌动蛋白内皮细胞表面 ANG-肌动蛋白复合物从细胞表面解离并加速组织型纤溶酶原激活物(tPA)催化的纤溶酶从纤溶酶原的生成。ANG-肌动蛋白复合物促进基底膜和细胞外基质的降解。该复合物允许内皮细胞渗透并迁移到血管周组织中。基底膜降解是血管生成的基本特征。ANG激活信号转导- ANG结合至170-kDa的 位于内皮细胞表面上的受体和引发第二信使系统。ANG与细胞表面肌动蛋白的结合导致细胞相关蛋白酶系统的活化,从而促进细胞侵袭。ERK1 / 2,蛋白激酶B / Akt1 已经提出通过ANG刺激来激活这些途径。ANG核易位-血管生成素通过受体介导的内吞作用和核定位序列辅助的核输入在内皮细胞中进行核易位。核定位信号(NLS)位于蛋白质的31-RRRGL-35中。核易位后,它增强rRNA转录。
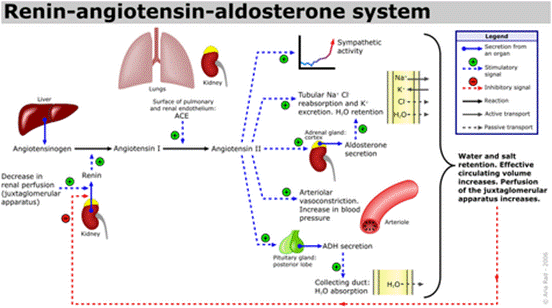
功能
血管紧张素受体存在于许多组织类型中,包括肾上腺皮质,肾小球,心脏,下丘脑,肝脏,胰腺,垂体,血小板,肾小管,子宫和血管平滑肌。通过放射性配体与拮抗剂的结合已鉴定出两种高亲和力受体亚型:氯沙坦(DuP 753 / MK954)鉴定AT1受体;PD123177和CGP42112A是AT2受体的标记。血管紧张素II可能在体液系统外的组织中局部产生。例如,它存在于大脑,肾脏和心脏。在大脑中,七肽血管紧张素(1-7)模仿血管紧张素II的某些作用,但可能直接由血管紧张素I形成。心脏中有非ACE介导的血管紧张素II产生的证据。血管内血管紧张素II受体与血管加压素和其他垂体后叶激素的中枢释放,交感神经外流增加,口渴反应以及可能的认知功能有关。血管紧张素II对心脏以及对生长/肥大的正性和变时性作用; 控制醛固酮的释放以及皮质醇和醛固酮分泌之间的平衡;并调节钠,氯和碳酸氢盐在肾脏内的运输。
ANG在血管生成中的功能-作为关键的血管生成因子,ANG与内皮细胞和平滑肌细胞相互作用,诱导多种细胞应答,包括细胞迁移,侵袭,增殖和肾小管结构形成。还已经报道ANG可直接诱导癌细胞的增殖。最近,ANG 基因被确定为潜在的肌萎缩性侧索硬化症(ALS)相关基因6。ANG可诱导多种人类癌症中的肿瘤生长,包括乳腺癌,宫颈癌,结肠癌,结肠直肠癌,子宫内膜癌,胃癌,肝癌,肾癌,卵巢癌,胰腺癌,前列腺癌和尿路上皮癌,以及星形细胞瘤,白血病,淋巴瘤,黑素瘤,骨肉瘤,和肾母细胞“肿瘤 6。ANG可能与肌萎缩性侧索硬化症有关-肌萎缩性侧索硬化症(ALS)是一种进展性迟发性神经退行性疾病,会影响上下运动神经元(MNs)。血管内皮生长因子是第一个被证明与ALS 7发病有关的血管生成因子。
Definition
Bradykinin is a nonapeptide that is mainly found in animal preparations that are treated with the venom of the snake, Bothrops jararaca1,2. It dialates blood vessels that in turn leads to decrease in blood pressure2. Bradykinin analogs are slightly modified structural derivatives of bradykinin that perform similar functions as bradykinin3.
Discovery
Bradykinin was discovered in the blood plasma of animals that were treated with the venom from the Brazilian snake, Bothrops jararaca1,2. The discovery was part of a study that was related to toxicology of snake bites. Bradykinin analogs were synthesized by solid-phase techniques in 1975 and their function was studied in rats and rabbits3.
Classification
Bradykinin is a 9 amino acid peptide that belongs to the kinin family of proteins4. It has homologs in several animals including other snakes, frog, dog and humans4.
Structural Characteristics
Bradykinin has the sequence Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg3. Several analogs of bradykinin have been synthesized. They are also nanopeptides containing substitutions of various amino acids of bradykinin. For example two analogs of bradykinin were synthesized one with 7-beta-homo-L-proline and the other with 8-beta-homo-L-phenylalanine substitutions3. It was found that both of them are resistant to enzymatic degradation3.
Mode of action
Bradykinin binds to two different kinin G protein coupled receptors- B1 and B25. Upon binding to these receptors it induces conversion of GTP to GDP which in turn triggers the conversion ATP to cAM which then acts as a second messenger resulting in the activation of genes. B1 receptor is expressed as a result of tissue injury and is found to play a role in inflammation while B2 receptor participates in the vasodilatory role of bradykinin5,6. Bradykinin analogs function is a similar fashion although depending on their structure they might have varying affinities to the receptors compared to bradykinin7. Also analogs of bradykinin have been synthesized that are specific to one of these receptors7.
Functions
Bradykinin is a potent endothelium-dependent vasodilator, causes contraction of non-vascular smooth muscle, increases vascular permeability and also is involved in the mechanism of pain. Bradykinin also causes natriuresis, contributing to a drop in blood pressure8. Bradykinin raises internal calcium levels in neocortical astrocytes causing them to release glutamate9. Overactivation of bradykinin is thought to play a role in a rare disease called Hereditary Angioedema, also known as Hereditary Angio-Neurotic Edema10.
Some analogs of bradykinin have been found to have prolonged hypotensive action compared to bradykinin (Eg: beta-H-Pro-bradykinin)3. Some analogs have relative or even lower potencies compared to bradykinin (Eg: HArg1-Bradykinin and HArg9 Bradykinin)7. Other analogs have been studied for their potential of finding bradykinin antagonists that might be useful in the treatment of angio-neurotic edema.
References
1. Partridge, SM (1948). (Title or abstract not available), Biochem. J., 42, 238.
2. Allen PK, Kusumam J, Yoji S, Yoshitaka N, Berhane G, Sesha R and Michael S (1998). Bradykinin formation: Plasma and tissue pathways and cellular interactions. Clinical reviews in allergy and immunology, 16, 4, 403-429.
3. Ondetti MA, Engel SL (1975). Bradykinin analogs containing beta.-homoamino acid, J. Med. Chem.,18 (7), 761–763.
4. Roseli A, Gomes S, Jair RC, Luis J and Valdemar H (1996). Met-Lys-Bradykinin-Ser, the kinin released from human kininogen by human pepsin. Immunopharmacology, 32, 76-79.
5. Peter GM, Amrita A, and Mauro P (2000). Association between Kinin B1 Receptor Expression and Leukocyte Trafficking across Mouse Mesenteric Postcapillary Venules. J Exp. Med., 192, 367-380.
6. Duchene J, Lecomte F, Ahmed S, Cayla C, Pesquero J, Bader M, Perretti M and Ahluwalia A, (2007). A Novel Inflammatory Pathway Involved in Leukocyte Recruitment: Role for the Kinin B1 Receptor and the Chemokine CXCL5. J Immunol., 179, 4849-4856.
7. Max ES, Phyllis AL (1974). Synthesis and pharmacology of homoarginine bradykinin analog. J. Med. Chem., 17 (11), pp 1227–1228.
8. Dendorfer A, Wolfrum S, Wagemann M, Qadri F, Dominiak P, (2001). Pathways of bradykinin degradation in blood and plasma of normotensive and hypertensive rats. Am J Physiol Heart Circ Physiol., 280:H2182
9. Kuoppala A, Lindstedt KA, Saarinen J, Kovanen PT, Kokkonen JO (2000). Inactivation of bradykinin by angiotensin-converting enzyme and by carboxypeptidase N in human plasma. Am J Physiol Heart Circ Physiol, 278(4):H1069-74.
10. Bas M, Adams V, Suvorava T, Niehues T, Hoffmann TK, Kojda G (2007). Nonallergic angioedema: role of bradykinin. Allergy, 62(8):842-56.
多肽Pyr-Gly-Leu-Pro-Pro-Gly-Pro-Pro-Ile-Pro-Pro-COOH的合成步骤:
1、合成CTC树脂:称取2.1g CTC Resin(如初始取代度约为0.37mmol/g)和0.93mmol Fmoc-Pro-OH于反应器中,加入适量DCM溶解氨基酸(需要注意,此时CTC树脂体积会增大好几倍,避免DCM溶液过少),再加入2.33mmol DIPEA(Mw:129.1,d:0.740g/ml),反应2-3小时后,可不抽滤溶液,直接加入1ml的HPLC级甲醇,封端半小时。依次用DMF洗涤2次,甲醇洗涤1次,DCM洗涤一次,甲醇洗涤一次,DCM洗涤一次,DMF洗涤2次(这里使用甲醇和DCM交替洗涤,是为了更好地去除其他溶质,有利于后续反应)。得到 Fmoc-Pro-CTC Resin。结构图如下:

2、脱Fmoc:加3倍树脂体积的20%Pip/DMF溶液,鼓氮气30分钟,然后2倍树脂体积的DMF 洗涤5次。得到 H2N-Pro-CTC Resin 。(此步骤脱除Fmoc基团,茚三酮检测为蓝色,Pip为哌啶)。结构图如下:

3、缩合:取2.33mmol Fmoc-Pro-OH 氨基酸,加入到上述树脂里,加适当DMF溶解氨基酸,再依次加入4.66mmol DIPEA,2.21mmol HBTU。反应30分钟后,取小样洗涤,茚三酮检测为无色。用2倍树脂体积的DMF 洗涤3次树脂。(洗涤树脂,去掉残留溶剂,为下一步反应做准备)。得到Fmoc-Pro-Pro-CTC Resin。氨基酸:DIPEA:HBTU:树脂=3:6:2.85:1(摩尔比)。结构图如下:
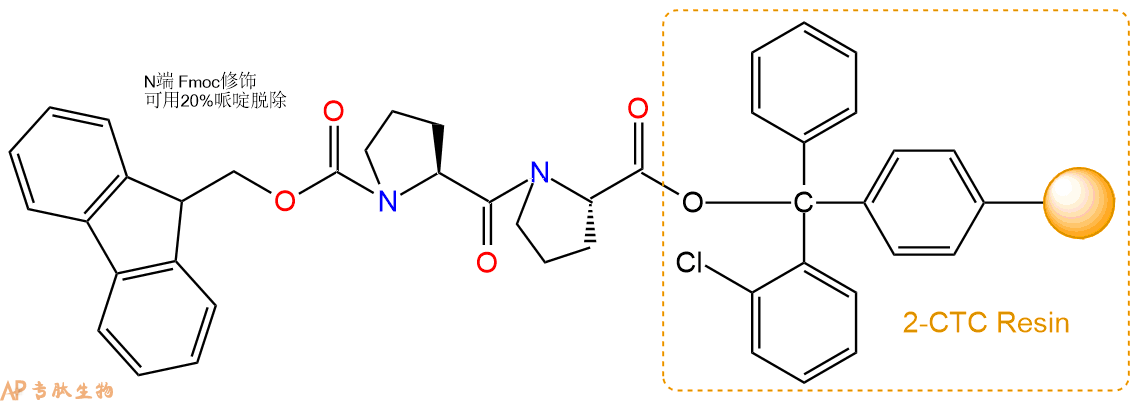
4、依次循环步骤二、步骤三,依次得到
H2N-Pro-Pro-CTC Resin
Fmoc-Ile-Pro-Pro-CTC Resin
H2N-Ile-Pro-Pro-CTC Resin
Fmoc-Pro-Ile-Pro-Pro-CTC Resin
H2N-Pro-Ile-Pro-Pro-CTC Resin
Fmoc-Pro-Pro-Ile-Pro-Pro-CTC Resin
H2N-Pro-Pro-Ile-Pro-Pro-CTC Resin
Fmoc-Gly-Pro-Pro-Ile-Pro-Pro-CTC Resin
H2N-Gly-Pro-Pro-Ile-Pro-Pro-CTC Resin
Fmoc-Pro-Gly-Pro-Pro-Ile-Pro-Pro-CTC Resin
H2N-Pro-Gly-Pro-Pro-Ile-Pro-Pro-CTC Resin
Fmoc-Pro-Pro-Gly-Pro-Pro-Ile-Pro-Pro-CTC Resin
H2N-Pro-Pro-Gly-Pro-Pro-Ile-Pro-Pro-CTC Resin
Fmoc-Leu-Pro-Pro-Gly-Pro-Pro-Ile-Pro-Pro-CTC Resin
H2N-Leu-Pro-Pro-Gly-Pro-Pro-Ile-Pro-Pro-CTC Resin
Fmoc-Gly-Leu-Pro-Pro-Gly-Pro-Pro-Ile-Pro-Pro-CTC Resin
以上中间结构,均可在专肽生物多肽计算器-多肽结构计算器中,一键画出。
最后再经过步骤二得到 H2N-Gly-Leu-Pro-Pro-Gly-Pro-Pro-Ile-Pro-Pro-CTC Resin,结构如下:
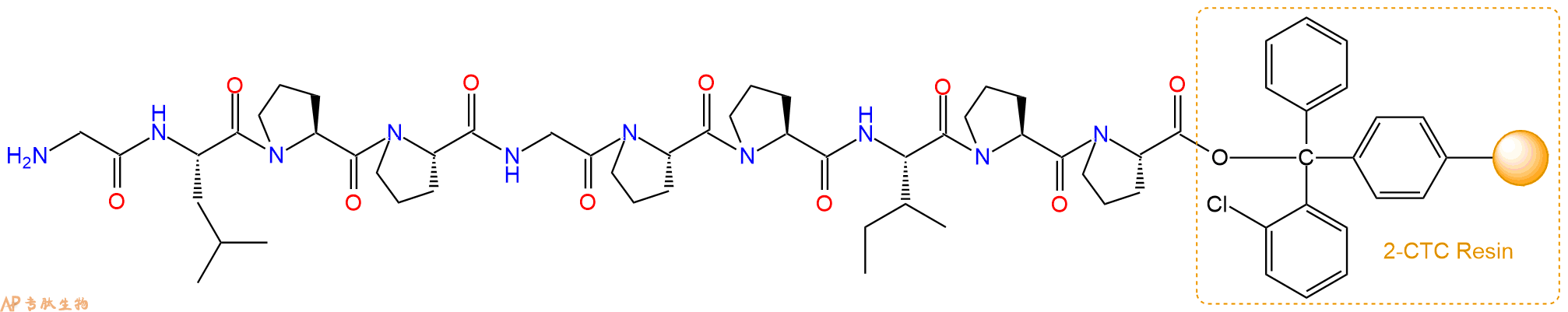
5、焦谷氨酸反应连接:在上述树脂中,加入适当DMF后,再加入2.33mmol 焦谷氨酸到树脂中,再加入4.66mmol DIPEA、2.21mmol HBTU,鼓氮气反应30分钟。用2倍树脂体积的DMF 洗涤3次树脂(洗涤树脂,去掉残留溶剂,为下一步反应做准备)。 得到Pyr-Gly-Leu-Pro-Pro-Gly-Pro-Pro-Ile-Pro-Pro-CTCResin。 结构如下:
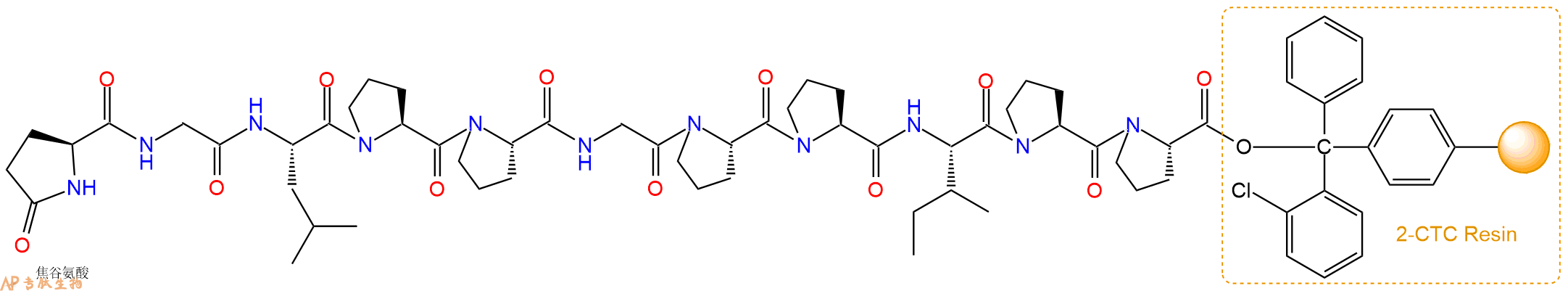
6、切割:6倍树脂体积的切割液(或每1g树脂加8ml左右的切割液),摇床摇晃 2小时,过滤掉树脂,用冰无水乙醚沉淀滤液,并用冰无水乙醚洗涤沉淀物3次,最后将沉淀物放真空干燥釜中,常温干燥24小试,得到粗品Pyr-Gly-Leu-Pro-Pro-Gly-Pro-Pro-Ile-Pro-Pro-COOH。结构图见产品结构图。
切割液选择:1)TFA:H2O=95%:5%
2)TFA:H2O:TIS=95%:2.5%:2.5%
3)三氟乙酸:茴香硫醚:1,2-乙二硫醇:苯酚:水=87.5%:5%:2.5%:2.5%:2.5%
(前两种适合没有容易氧化的氨基酸,例如Trp、Cys、Met。第三种适合几乎所有的序列。)
6、纯化冻干:使用液相色谱纯化,收集目标峰液体,进行冻干,获得蓬松的粉末状固体多肽。不过这时要取小样复测下纯度 是否目标纯度。
7、最后总结:
杭州专肽生物技术有限公司(ALLPEPTIDE https://www.allpeptide.com)主营定制多肽合成业务,提供各类长肽,短肽,环肽,提供各类修饰肽,如:荧光标记修饰(CY3、CY5、CY5.5、CY7、FAM、FITC、Rhodamine B、TAMRA等),功能基团修饰肽(叠氮、炔基、DBCO、DOTA、NOTA等),同位素标记肽(N15、C13),订书肽(Stapled Peptide),脂肪酸修饰肽(Pal、Myr、Ste),磷酸化修饰肽(P-Ser、P-Thr、P-Tyr),环肽(酰胺键环肽、一对或者多对二硫键环),生物素标记肽,PEG修饰肽,甲基化修饰肽
以上所有内容,为专肽生物原创内容,请勿发布到其他网站上。





