
编号:153469
CAS号:1678415-18-3
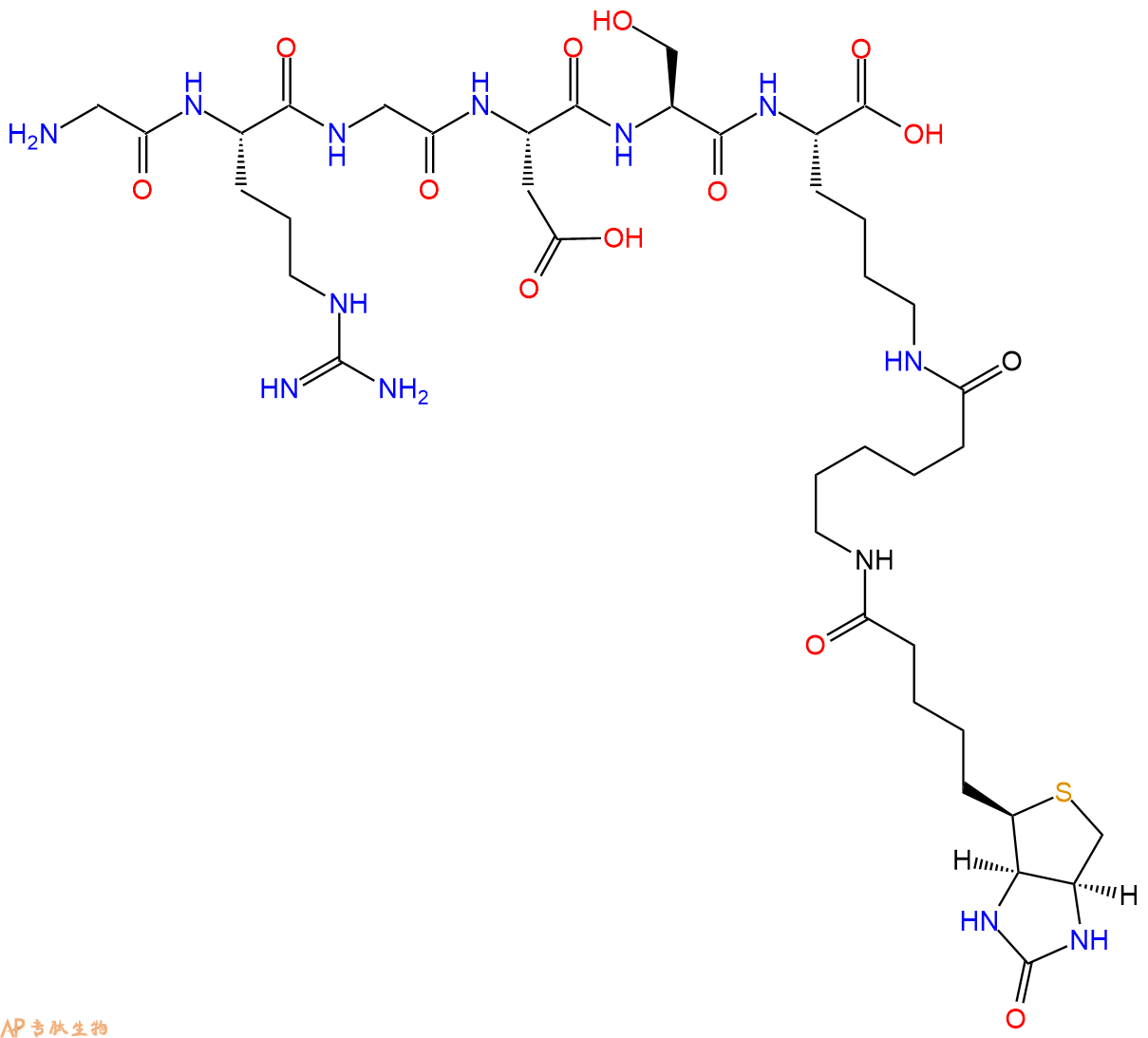
单字母:Biotinyl-KCNTATCATQRLANFLVHSSNNFGAILSSTNVGSNTY-NH2(Disulfide Bridge:C2-C7)
| 编号: | 153469 |
| 中文名称: | 胰淀素Biotinyl-Amylin (1 - 37), (human) |
| 英文名: | Biotinyl-Amylin (1 - 37), (human) |
| CAS号: | 1678415-18-3 |
| 单字母: | Biotinyl-KCNTATCATQRLANFLVHSSNNFGAILSSTNVGSNTY-NH2(Disulfide Bridge:C2-C7) |
| 三字母: | Biotinyl-Lys-Cys-Asn-Thr-Ala-Thr-Cys-Ala-Thr-Gln-Arg-Leu-Ala-Asn-Phe-Leu-Val-His-Ser-Ser-Asn-Asn-Phe-Gly-Ala-Ile-Leu-Ser-Ser-Thr-Asn-Val-Gly-Ser-Asn-Thr-Tyr-NH2(Disulfide Bridge:Cys2-Cys7) |
| 氨基酸个数: | 37 |
| 分子式: | C175H275N53O57S3 |
| 平均分子量: | 4129.57 |
| 精确分子量: | 4126.94 |
| 等电点(PI): | - |
| pH=7.0时的净电荷数: | 5.17 |
| 平均亲水性: | -0.46285714285714 |
| 疏水性值: | -0.09 |
| 消光系数: | 1490 |
| 来源: | 人工化学合成,仅限科学研究使用,不得用于人体。 |
| 盐体系: | 可选TFA、HAc、HCl或其它 |
| 储存条件: | 负80℃至负20℃ |
| 标签: | 生物素标记肽(Biotinyl) 二硫键环肽 胰高血糖素及相关肽 胰淀素(Amylin) |
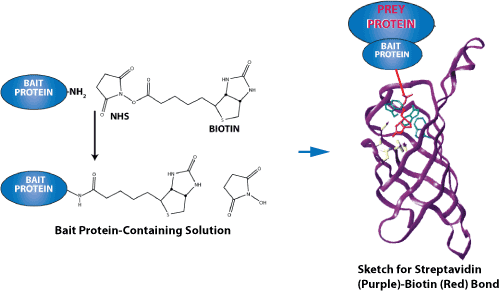
专肽生物合成用于蛋白质-蛋白质相互作用研究的生物素化肽。尽管生物素可以在 N 端或 C 端引入(通过赖氨酸残基),但我们建议使用 N 端修饰,因为它成本低、成功率高、周转时间短且易于操作。因为多肽合成是从 C 端到 N 端合成的,因此,N 端修饰是 SPPS步骤的最后一步,不需要额外的特定缩合步骤。相比之下,C 端修饰需要额外的步骤,并且通常更复杂。当然,原则上生物素可以定位在任何地方。

生物素可以通过多种不同的接头或间隔物与肽分离。尽管如此,还是建议包含一个灵活的间隔物,例如 Ahx(一个 6 碳接头),以使生物素标签更加稳定或灵活。
专肽生物在 N 端或 C 端提供生物素化:生物素-N 端、赖氨酸-生物素-肽中间和赖氨酸-生物素-C 端。
专肽生物还可以使用 Ahx 接头或长碳 (LC) 接头提供生物素化:生物素-Ahx-N 末端、Lys-Ahx-生物素-肽中间、Lys-Ahx-生物素-C-末端。
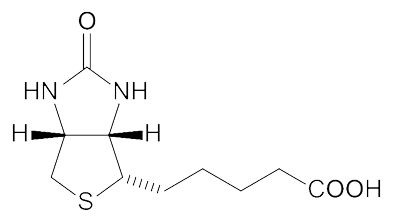
(生物素结构)
示例:
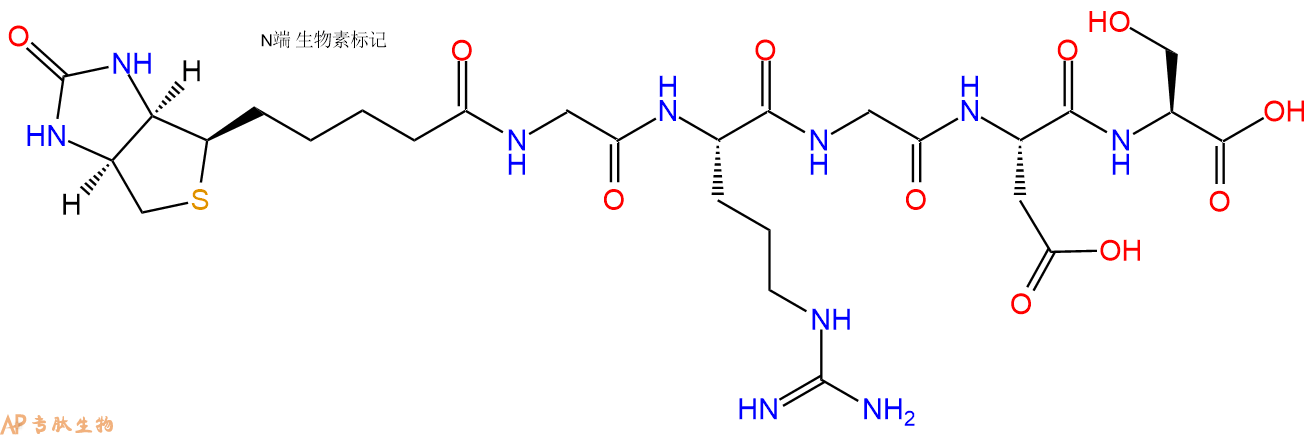
GRGDS在N端和C端标记生物素的结构展示。
1、GRGDS在N端标记生物素,不增加Ahx 接头
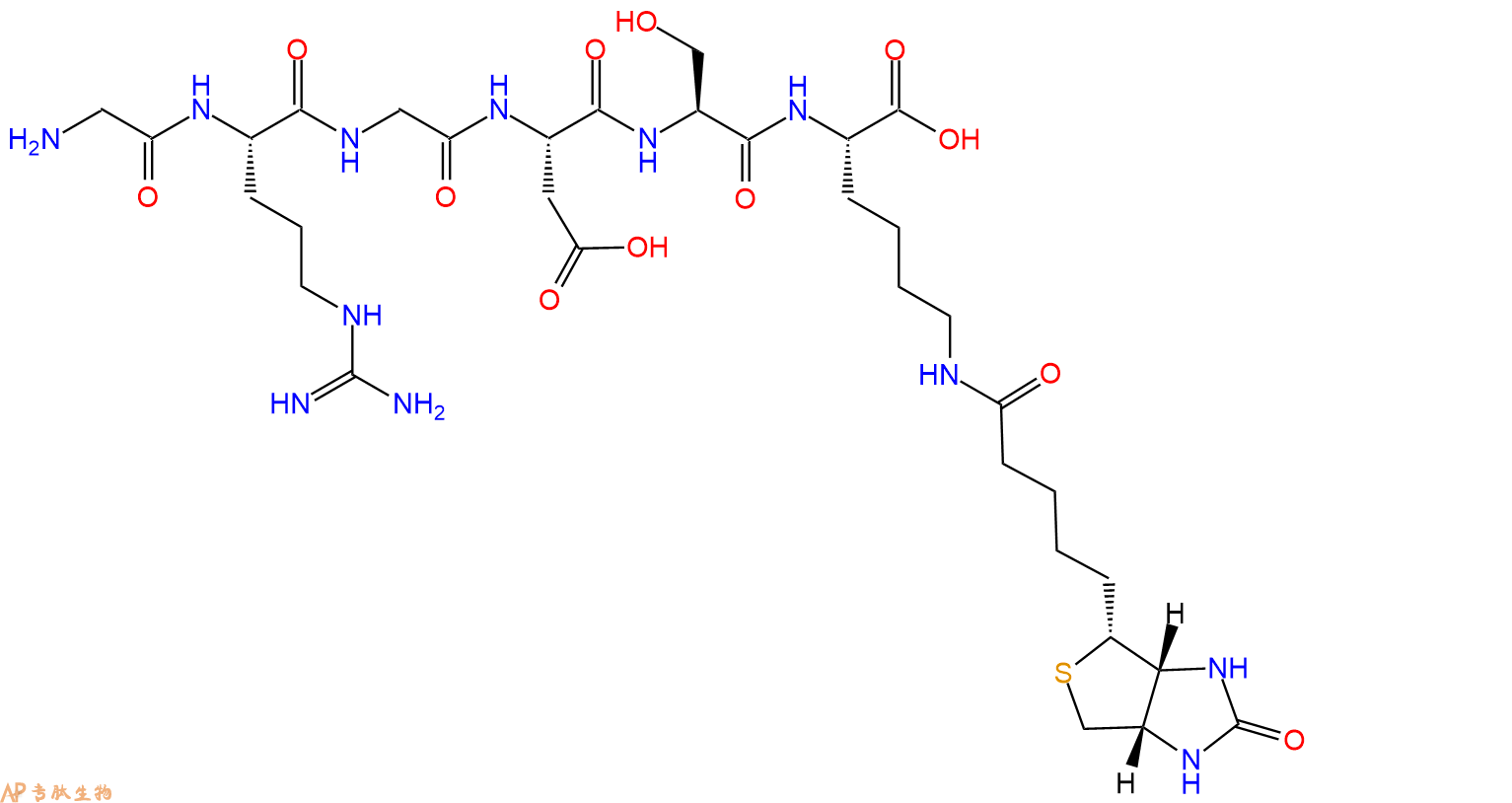
2、GRGDS在N端标记生物素,增加一个Ahx 接头

3、GRGDS在C端标记生物素,不增加Ahx 接头
4、GRGDS在C端标记生物素,增加一个Ahx 接头。
二硫键广泛存在与蛋白结构中,对稳定蛋白结构具有非常重要的意义,二硫键一般是通过序列中的2个Cys的巯基,经氧化形成。
形成二硫键的方法很多:空气氧化法,DMSO氧化法,过氧化氢氧化法等。
二硫键的合成过程, 可以通过Ellman检测以及HPLC检测方法对其反应进程进行监测。
如果多肽中只含有1对Cys,那二硫键的形成是简单的。多肽经固相或液相合成,然后在pH8-9的溶液中进行氧化。
当需要形成2对或2对以上的二硫键时,合成过程则相对复杂。尽管二硫键的形成通常是在合成方案的最后阶段完成,但有时引入预先形成的二硫化物是有利于连合或延长肽链的。通常采用的巯基保护基有trt, Acm, Mmt, tBu, Bzl, Mob, Tmob等多种基团。我们分别列出两种以2-Cl树脂和Rink树脂为载体合成的多肽上多对二硫键形成路线:
二硫键反应条件选择
二硫键即为蛋白质或多肽分子中两个不同位点Cys的巯基(-SH)被氧化形成的S-S共价键。 一条肽链上不同位置的氨基酸之间形成的二硫键,可以将肽链折叠成特定的空间结构。多肽分 子通常分子量较大,空间结构复杂,结构中形成二硫键时要求两个半胱氨酸在空间距离上接近。 此外,多肽结构中还原态的巯基化学性质活泼,容易发生其他的副反应,而且肽链上其他侧链 也可能会发生一系列修饰,因此,肽链进行修饰所选取的氧化剂和氧化条件是反应的关键因素, 反应机理也比较复杂,既可能是自由基反应,也可能是离子反应。
反应条件有多种选择,比如空气氧化,DMSO氧化等温和的氧化过程,也可以采用H2O2,I2, 汞盐等激烈的反应条件。
空气氧化法: 空气氧化法形成二硫键是多肽合成中最经典的方法,通常是将巯基处于还原态的多肽溶于水中,在近中性或弱碱性条件下(PH值6.5-10),反应24小时以上。为了降低分子之间二硫键形成的可能,该方法通常需要在低浓度条件下进行。
碘氧化法:将多肽溶于25%的甲醇水溶液或30%的醋酸水溶液中,逐滴滴加10-15mol/L的碘进行氧化,反应15-40min。当肽链中含有对碘比较敏感的Tyr、Trp、Met和His的残基时,氧化条件要控制的更精确,氧化完后,立即加入维生素C或硫代硫酸钠除去过量的碘。 当序列中有两对或多对二硫键需要成环时,通常有两种情况:
自然随机成环: 序列中的Cys之间随机成环,与一对二硫键成环条件相似;
定点成环: 定点成环即序列中的Cys按照设计要求形成二硫键,反应过程相对复杂。在 固相合成多肽之前,需要提前设计几对二硫键形成的顺序和方法路线,选择不同的侧链 巯基保护基,利用其性质差异,分步氧化形成两对或多对二硫键。 通常采用的巯基保护 基有trt, Acm, Mmt, tBu, Bzl, Mob, Tmob等多种基团。
定义
胰高血糖素是众所周知的一种胰岛分泌的肽激素,它参与葡萄糖代谢的控制。
相关肽
胰高血糖素被合成为胰高血糖素,并经蛋白水解加工以在胰岛的α细胞内产生胰高血糖素。胰高血糖素原也在肠内表达,在那里它不被加工成胰高血糖素,而是被加工成胰高血糖素样肽家族。在胰腺和肠道中,都会产生三种类型的产品:
发现
胰高血糖素最初由罗切斯特大学的CP Kimball和John R. Murlin于1923年纯化。胰高血糖素的氨基酸序列在1950年代后期进行了描述2。
结构特征
胰高血糖素是由29个氨基酸组成的线性肽。它的主要序列在脊椎动物中几乎是完全保守的,并且在结构上与肽激素1的促分泌素家族有关。
行动方式
胰高血糖素通过其在细胞表面的受体发出信号。胰高血糖素 与胰高血糖素受体的细胞外环的结合导致 后者的构象变化,从而导致随后的偶联的G蛋白的活化。 已知至少两类G蛋白 与胰高血糖素受体的信号转导有关并参与其中, 即G s 和G q。G s 的激活导致 腺苷酸环化酶的激活,细胞内cAMP水平的增加,以及 随后蛋白激酶A(PKA)的激活。激活 的G q导致磷脂酶C,生产的激活 肌醇1,4,5-三磷酸,并随后释放细胞内 钙3。
参考:
1.Kieffer TJ and Habener JF (1999). The Glucagon-Like Peptides. Endocrine Reviews, 20 (6), 876-913
2. Jiang G, Zhang BB (2003). Glucagon and regulation of glucose metabolism. Am J Physiol Endocrinol Metab., 284(4), E671-8.
3. Kimball CP, Murlin JR (1923). Aqueous extracts of pancreas. III. Some precipitation reactions of insulin. J. Biol. Chem., 58(1), 337
4. Blache P, Kervran A, Bataille D (1988). Oxyntomodulin and glicentin: brain-gut peptides in the rat. Endocrinology, 123(6), 2782-7.
Definition
Amylin or Islet amyloid polypeptide (IAPP), a 37-amino acid peptide is secreted by beta-islet cells of the pancreas and a major component of the amyloid deposits in persons with type 2 diabetes mellitus. Amylin may be referred to as insulin’s “fraternal twin” as it is constitutively expressed with insulin in response to elevations of plasma glucose.
Discovery
The knowledge of occurrence of amyloid deposits in islets of Langerhans, major pathologic feature of diabetics has been known for a century. But, the discovery of amylin as a major component of amyloid deposits was by two independent groups in 19871, 2.
Structural characteristics
The human amylin has an amino acid sequence KCNTATCATQRLANFLVHSSNNFGAILSSTNVGSNTY, with a disulfide bridge between cysteine residues 2 and 7. The features, amidated C-terminus and the disulfide bridge are necessary for the full biological activity of amylin3. Amylin amino acid sequence is 46% and 43% identical to those of the calcitonin gene-related neuropeptides CGRP-2 and CGRP-1. The (20-29) fragment of amylin is critical to the pathogenesis of islet amyloid4.
Mechanism of action
Amylin is synthesized, packaged within the golgi apparatus and secreted within the secretory granule by the islet beta cell. They have binding sites within the renal cortex in the area of the juxtaglomerular apparatus and it activates the rennin angiotensin aldosterone system. It also acts upon the circulatory system by inhibiting the secretion of the atrial natriuretic peptide (ANP)5.
Function
Amylin inhibits gastric emptying and is important in controlling and delaying the rate of meal derived glucose. It inhibits hepatic release and production of glucose in the postprandial period. They also have been shown to inhibit glucagon secretion and somatostatin. Amylin causes vasodilatation by dilating the non-striated muscles of the blood vessels. It is also known to increase thirst level which indicates it has an action within the central nervous system6.
References
1. Cooper GJ, Willis AC, Clark A, Turner RC, Sim RB, Reid KB (1987). Purification and characterization of a peptide from amyloid-rich pancreases of type 2 diabetic patients. Proc Natl Acad Sci., 84(23):8628-32.
2. Westermark P, Wernstedt C, O'Brien TD, Hayden DW, Johnson KH (1987). Islet amyloid in type 2 human diabetes mellitus and adult diabetic cats contains a novel putative polypeptide hormone. Am J Pathol, 127(3):414-417.
3. Roberts AN, Leighton B, Todd JA, Cockburn D, Schofield PN, Sutton R, Holt S, Boyd Y, Day AJ, Foot EA, et al,(1989). Molecular and functional characterization of amylin, a peptide associated with type 2 diabetes mellitus. Proc Natl Acad Sci, 86(24):9662-9666.
4. Guidobono F, Pagani F, Ticozzi C, Sibilia V, Pecile A, Netti C (1997). Protection by amylin of gastric erosions induced by indomethacin or ethanol in rats. Br J Pharmacol, 120(4):581-586.
5. Piao FL, Cao C, Han JH, Kim SZ, Cho KW, Kim SH (2004). Amylin-induced suppression of ANP secretion through receptors for CGRP1 and salmon calcitonin. Regul Pept, 117: 59-166.
6. Hayden MR, Tyagi SC (2002). Islet redox stress: the manifold toxicities of insulin resistance, metabolic syndrome and amylin derived islet amyloid in type 2 diabetes mellitus. Journal of the Pancrease, 3(4): 86-108.
N.G.Milton and J.R.Harris, ScientificWorldJournal, 10, 879 (2010);http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20495767
N.G.Milton and J.R.Harris, ScientificWorldJournal, 10, 879 (2010);http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=20495767
L.-M.Yan et al., Proc. Natl. Acad. Sci. USA, 103, 2046 (2006);http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=16467158
| 编号 | 名称 | CAS号 |
| 151279 | 胰淀素Amylin (1 - 37), human, amide | 122384-88-7 |
| H2N-KCNTATCATQRLANFLVHSSNNFGAILSSTNVGSNTY-NH2(Disulfide Bridge:C2-C7) | ||
| Amylin, amide, human是一个由37个氨基酸组成的多肽,是一种与胰岛素共分泌的胰腺激素,它在代谢和葡萄糖稳态中发挥作用。Amylin, amide, human可以抑制胰高血糖素分泌,延迟胃的排空。 | ||





