| 编号: | 149921 |
| 中文名称: | 基质金属蛋白酶MMP Substrate V, Fluorogenic |
| 英文名: | MMPSubstrateV, Fluorogenic |
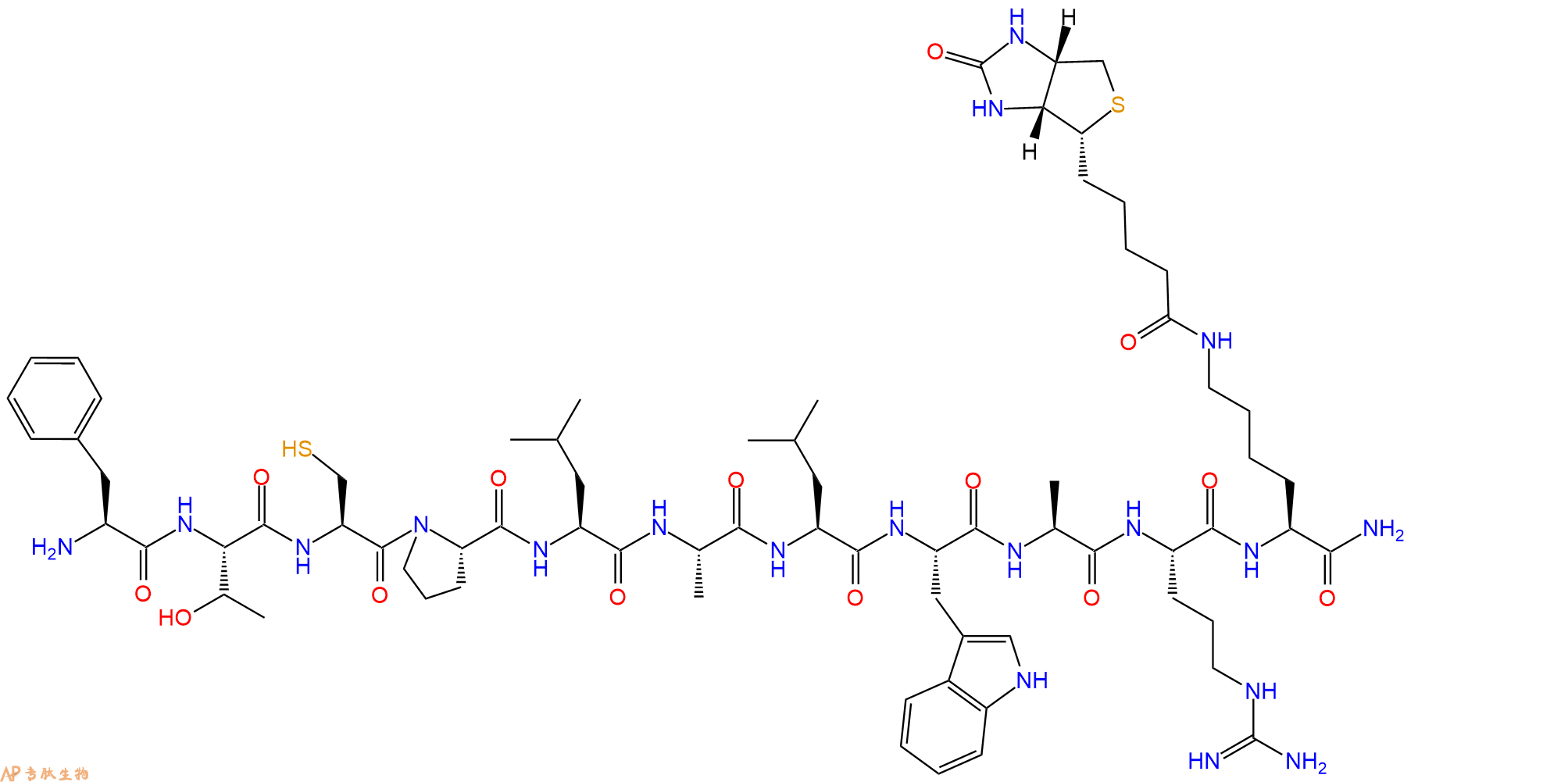
| 单字母: | H2N-FTCPLALWAR-K(Biotin)-NH2 |
| 三字母: | H2N N端氨基 -Phe苯丙氨酸 -Thr苏氨酸 -Cys半胱氨酸 -Pro脯氨酸 -Leu亮氨酸 -Ala丙氨酸 -Leu亮氨酸 -Trp色氨酸 -Ala丙氨酸 -Arg精氨酸 -Lys(Biotin)赖氨酸侧链标记生物素 -NH2C端酰胺化 |
| 氨基酸个数: | 11 |
| 分子式: | C72H111N19O14S2 |
| 平均分子量: | 1530.9 |
| 精确分子量: | 1529.8 |
| 等电点(PI): | - |
| pH=7.0时的净电荷数: | 2.94 |
| 平均亲水性: | -0.98888888888889 |
| 疏水性值: | 0.88 |
| 外观与性状: | 白色粉末状固体 |
| 消光系数: | 5500 |
| 来源: | 人工化学合成,仅限科学研究使用,不得用于人体。 |
| 纯度: | 95%、98% |
| 盐体系: | 可选TFA、HAc、HCl或其它 |
| 生成周期: | 2-3周 |
| 储存条件: | 负80℃至负20℃ |
| 标签: | 生物素标记肽(Biotinyl) 基质金属蛋白酶底物 |
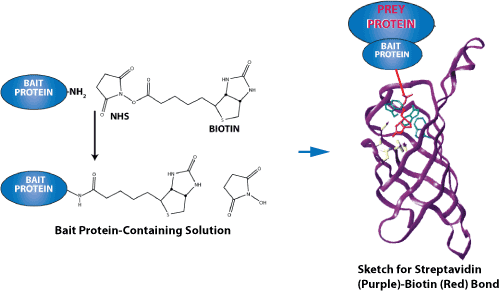
专肽生物合成用于蛋白质-蛋白质相互作用研究的生物素化肽。尽管生物素可以在 N 端或 C 端引入(通过赖氨酸残基),但我们建议使用 N 端修饰,因为它成本低、成功率高、周转时间短且易于操作。因为多肽合成是从 C 端到 N 端合成的,因此,N 端修饰是 SPPS步骤的最后一步,不需要额外的特定缩合步骤。相比之下,C 端修饰需要额外的步骤,并且通常更复杂。当然,原则上生物素可以定位在任何地方。

生物素可以通过多种不同的接头或间隔物与肽分离。尽管如此,还是建议包含一个灵活的间隔物,例如 Ahx(一个 6 碳接头),以使生物素标签更加稳定或灵活。
专肽生物在 N 端或 C 端提供生物素化:生物素-N 端、赖氨酸-生物素-肽中间和赖氨酸-生物素-C 端。
专肽生物还可以使用 Ahx 接头或长碳 (LC) 接头提供生物素化:生物素-Ahx-N 末端、Lys-Ahx-生物素-肽中间、Lys-Ahx-生物素-C-末端。
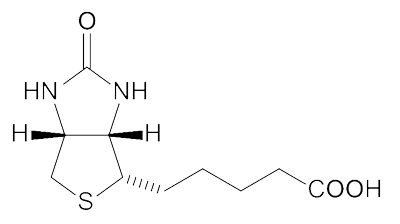
(生物素结构)
示例:
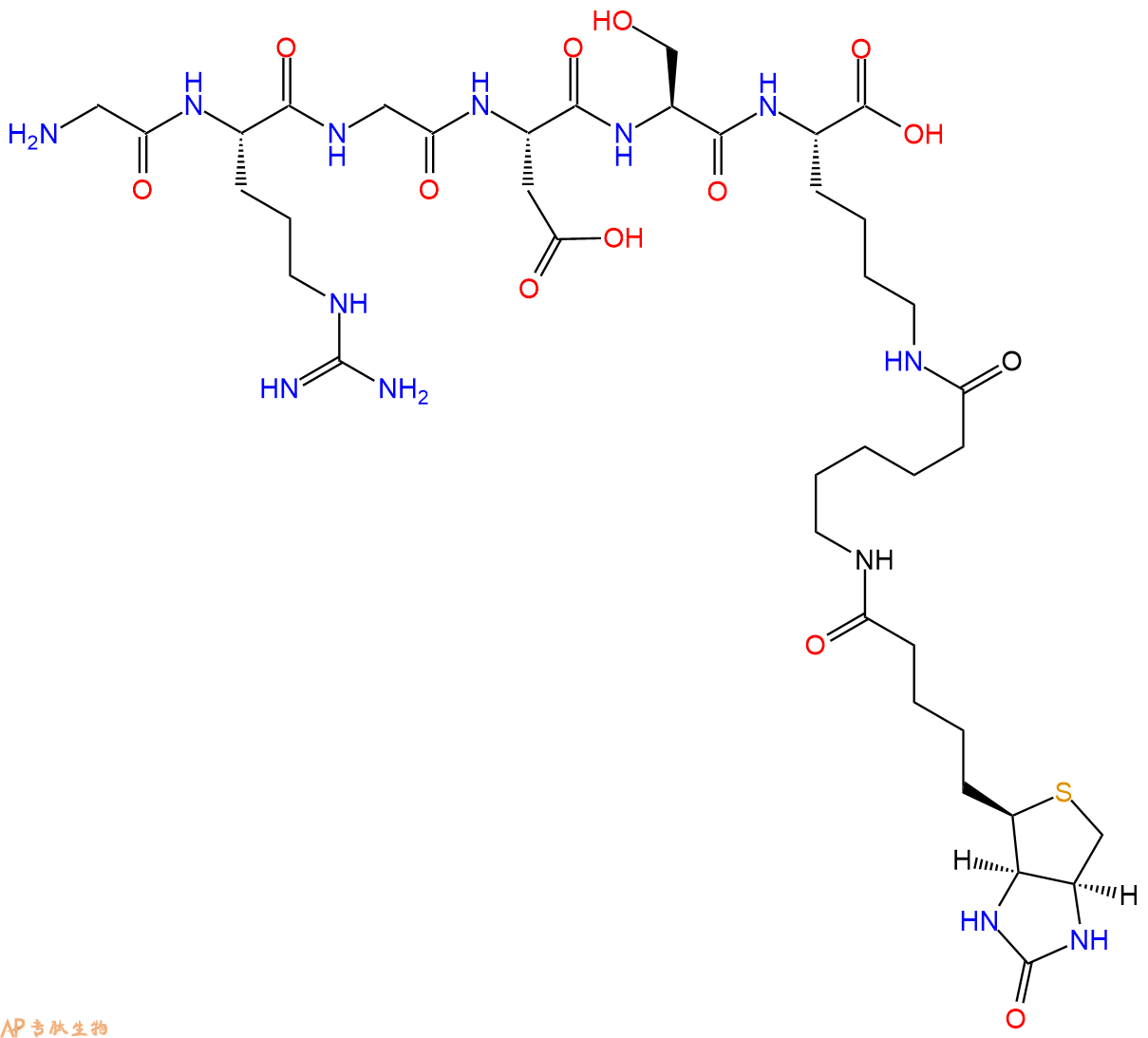
GRGDS在N端和C端标记生物素的结构展示。
1、GRGDS在N端标记生物素,不增加Ahx 接头
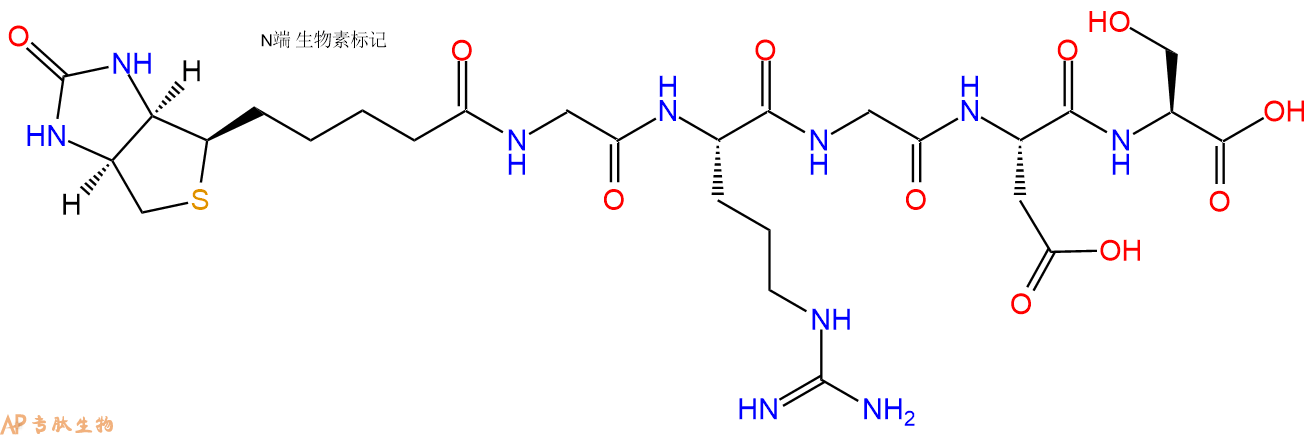
2、GRGDS在N端标记生物素,增加一个Ahx 接头

3、GRGDS在C端标记生物素,不增加Ahx 接头
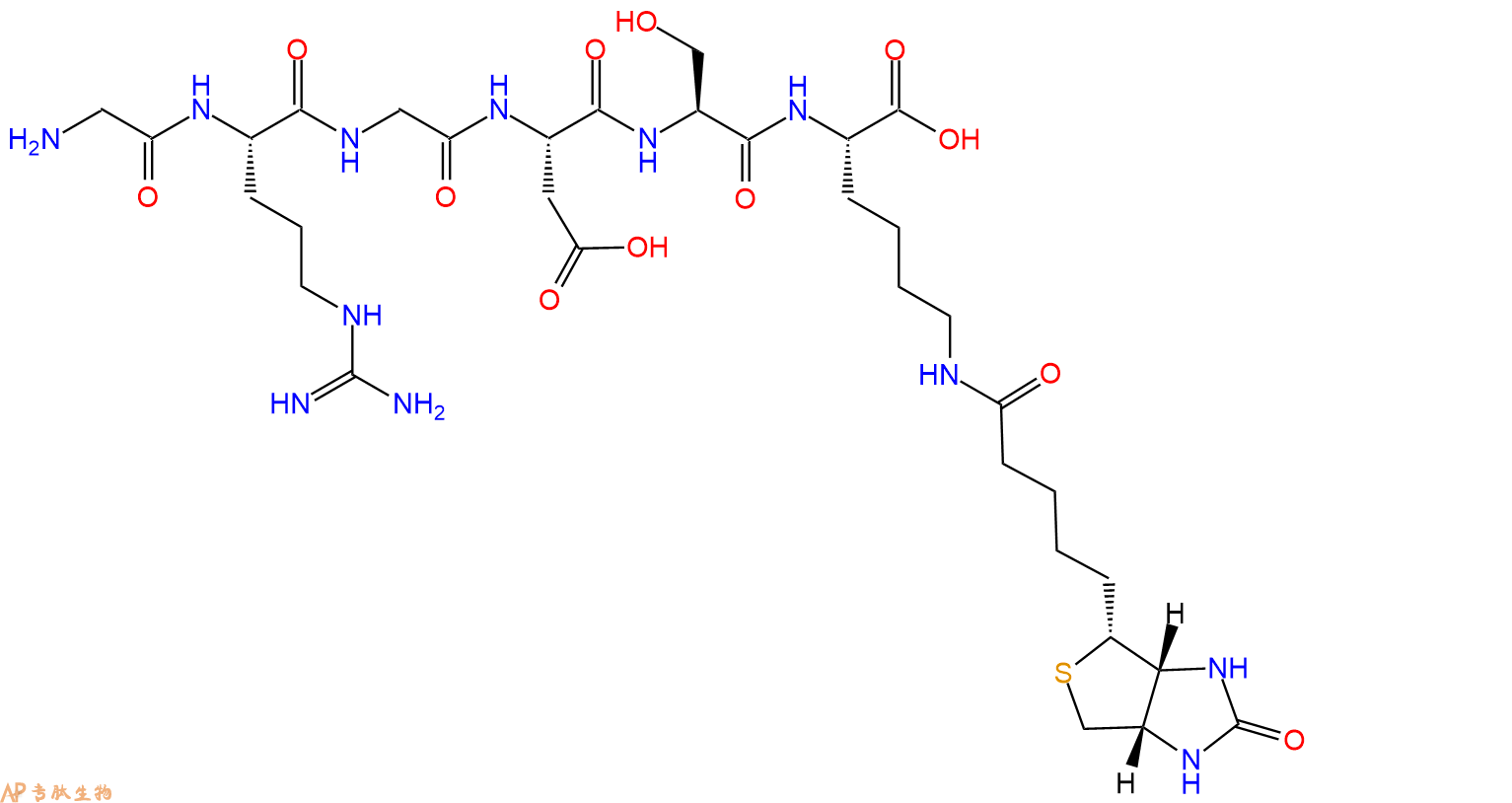
4、GRGDS在C端标记生物素,增加一个Ahx 接头。
定义
基质金属蛋白酶(MMP)属于锌内肽酶家族,统称为metzincins。metzincin超家族的特征是高度保守的基序,该基序包含在催化位点与锌结合的三个组氨酸和位于活性位点下方的保守的蛋氨酸。
发现
间质胶原酶,首先被确定的MMP家族成员,最初是在旨在解释designed变态为青蛙1的胶原重塑的实验中发现的。MMP家族由20多个共享相同功能域的相关锌依赖性酶组成。这些酶既具有通常基于优选底物的描述性名称,又具有基于发现顺序的MMP编号系统1。
结构特征
MMP的基本结构由以下同源结构域组成:1)将MMP引导至分泌或质膜插入途径的信号肽;2)前结构域,通过占据活性位点锌使酶具有潜伏期,使底物难以接近催化酶;3)含锌的催化域;4)溶血毒素域,介导与底物的相互作用并赋予酶特异性;5)连接催化和血红蛋白结构域的铰链区。MMP7或基质溶素是最小的MMP,缺少血红素结构域,但在底物降解中表现出特异性。额外的结构域和底物特异性导致MMP分为亚组。
MMP的蛋白质结构中两个序列基序高度保守。在所有MMP的催化域中发现的共有基序HExGHxxGxxH,包含3个与活性中心的锌离子(Zn)配位的组氨酸。PRCGxPD基序位于MMPs前结构域的C末端;该基因座的半胱氨酸残基(C)与活性中心的锌原子的配位赋予了酶2、3潜伏期。
行动方式
MMP的体内活性在几个水平上受到严格控制。这些酶通常以极低的量表达,其转录受到细胞因子和生长因子(如白介素(IL-1,IL-4,IL-6),转化生长因子(EGF,HGF,TGFβ)的正向或负向严格调控。 ),或肿瘤坏死因子α(TNFα的)4, 5。这些调节分子中的一些可以被MMP蛋白水解激活或失活(反馈作用)。转录后,MMP活性受到位于新合成的酶的N末端的前肽所赋予的潜伏期的限制。从细胞分泌后,MMPs的激活取决于前结构域与催化位点的相互作用的破坏,这可能通过前结构域的构象变化或蛋白水解去除而发生。在其前肽中含有弗林蛋白酶样识别结构域的MMP(MMP11,MT-MMP,MMP28)可以通过枯草杆菌蛋白酶丝氨酸蛋白酶家族的成员在反式高尔基体网络中被激活。MMP14在细胞表面的proMMP2激活中起着不可或缺的作用。分泌的MMP的胞外蛋白水解激活可以通过丝氨酸蛋白酶(如纤溶酶)介导,这暗示着这两个酶基团在ECM重塑中具有相互依赖性。某些活动的MMP可以激活其他proMMP,例如MMP9和MMP1的MMP3激活。激活后,MMP会受到内源性抑制剂,自降解和选择性内吞作用的进一步调节。已经证明通过低密度脂蛋白受体相关蛋白(LRP)机制内吞MMP2、9和137。
功能
MMP参与癌症的各个方面-MMP诱导的肝素结合上皮生长因子,胰岛素样生长因子和成纤维细胞生长因子从细胞表面释放(脱落),促进细胞增殖。另一方面,由MMP释放和激活ECM螯合的TGFβ可以导致细胞增殖受到抑制。
炎症性疾病-许多报道暗示MMP1,MMP3和MMP9参与类风湿和骨关节炎。
心血管疾病-大量研究表明,动脉粥样硬化和动脉瘤形成部位6的MMP,尤其是MMP9水平升高。已经提出MMP代表冠状动脉疾病患者中炎症的敏感标志。
肺部疾病- MMP的水平升高已经牵涉在各种肺部疾病,包括急性呼吸窘迫综合征,哮喘,支气管扩张和囊性纤维化的病理生理学。MMP,EMMPRIN和TIMPs是由肺中的许多常驻细胞产生的,因此使它们在疾病中的作用7的分析变得复杂。
中枢神经系统疾病-在观察到MMP9在类似于多发性硬化症和格林-巴利综合症的动物模型中的关键作用之后,MMPs参与了几种不同类型的神经系统疾病。
休克综合征- MMP8和MMP9存储在多形核白细胞的颗粒。这些细胞是炎症和感染过程中的关键效应器。这些MMP在休克中的作用得到了对MMP9缺陷型小鼠的研究的支持,这些小鼠被证明对内毒素休克具有抗性。Dubois等人[ 8]提出,特定的MMP9抑制作用是治疗败血性休克综合症的一种潜在方法。
参考
1. Gross J, Lapiere CM (1962). Collagenolytic activity in amphibian tissues; a tissue culture assay. PNAS., 48:1014-1022.
2. Nagase H, Woessner F (1999). Matrix metalloproteinases. J Biol Chem., 274(31):21491-21494.
3. Birkedal-Hansen H. (1995). Proteolytic remodeling of extracellular matrix. Curr Opin Cell Biol., 7:728-735.
4. Zucker S, Pei D, Cao J, Lopez-Otin C (2003). Membrane type-matrix metalloproteinases (MT-MMP). Cell Surface Proteases., 54:1-74.
5. Yang Z, Strickland DK, Bornstein P (2001). Extracellular MMP-2 levels are regulated by the low-density lipoprotein-related scavenger receptor and thrombospondin. J Biol Chem., 276: 8403-8408.
6. Van den Steen PE, Dubois B, Nelissen I, Rudd PM, Dwek RA, Opdenakker G (2002). Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9 (MMP-9). Crit Rev Biochem Mol Biol,. 37:376-536.
7. Haseneen N, Vaday G, Zucker S, Foda HD (2003). Mechanical stretch induces MMP-2 release and activation in lung endothelium: role of EMMPRIN. Am J Physio Lung Cell Mol Physiol., 165:541-547.
8. Dubois B, Starckx S, Pagenstecher A, Oord J, Arnold B, Opdenakker G. Gelatinase B (2002). Deficiency protects against endotoxin shock. Eur J Immunol., 32:2163-2171.





