iRGD 肿瘤穿透肽修饰的溶瘤腺病毒显示增强的肿瘤转导、肿瘤内传播和抗肿瘤功效。基因疗法。
编号:128437
CAS号:1392278-76-0
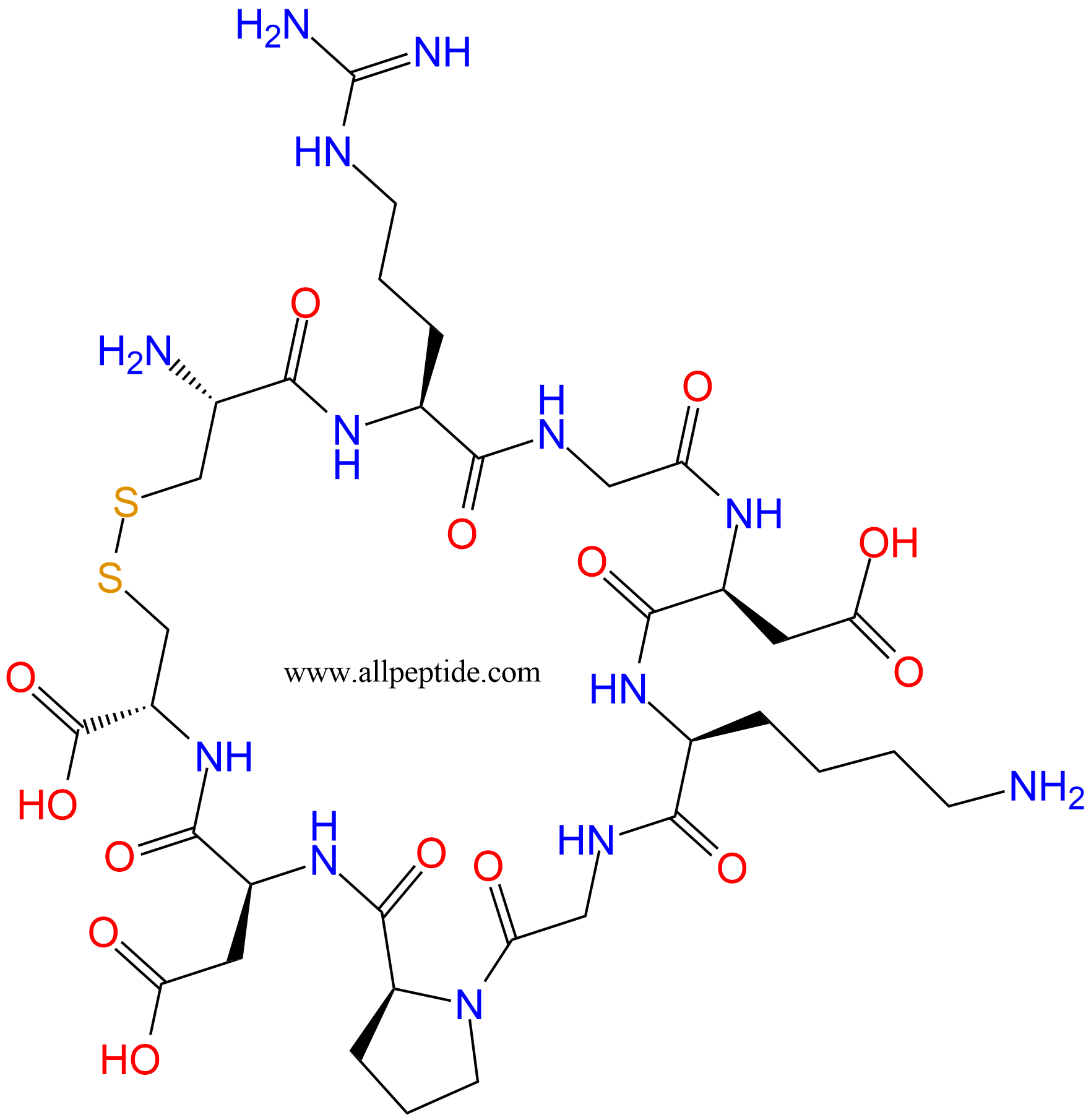
单字母:H2N-CRGDKGPDC-OH(Disulfide Bridge:C1-C9)
| 编号: | 128437 |
| 中文名称: | RGD环肽:iRGD peptide、c(CRGDKGPDC) |
| 英文名: | c(CRGDKGPDC) |
| CAS号: | 1392278-76-0 |
| 单字母: | H2N-CRGDKGPDC-OH(Disulfide Bridge:C1-C9) |
| 三字母: | H2N-Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys-OH(Disulfide Bridge:Cys1-Cys9) |
| 氨基酸个数: | 9 |
| 分子式: | C35H57N13O14S2 |
| 平均分子量: | 948.04 |
| 精确分子量: | 947.36 |
| 等电点(PI): | 9.92 |
| pH=7.0时的净电荷数: | 2.91 |
| 平均亲水性: | 1.6666666666667 |
| 疏水性值: | -1.42 |
| 外观与性状: | 粉末状固体 |
| 消光系数: | - |
| 来源: | 人工化学合成,仅限科学研究使用,不得用于人体。 |
| 储存条件: | 负80℃至负20℃ |
| 标签: | 二硫键环肽 靶向多肽 RGD、RAD肽 细胞穿膜肽(Cell permeable peptides, CPPs) 现货多肽 |
iRGD 肿瘤穿透肽修饰的溶瘤腺病毒显示增强的肿瘤转导、肿瘤内传播和抗肿瘤功效。基因疗法。
iRGD (CRGDKGPDC) (Disulfide bridge: C1-C9)是一种由 9 个氨基酸组成的二硫键环肽,由第一位半胱氨酸C与末尾的C巯基之间氧化形成二硫键。它能够与整合素结合后酶解产生 CRGDK ,再与 神经纤毛蛋白-1 (neuropilin-1) 相互作用,从而促进药物的组织渗透,具有靶向肿瘤以及肿瘤渗透的作用。
二硫键广泛存在与蛋白结构中,对稳定蛋白结构具有非常重要的意义,二硫键一般是通过序列中的2个Cys的巯基,经氧化形成。
形成二硫键的方法很多:空气氧化法,DMSO氧化法,过氧化氢氧化法等。
二硫键的合成过程, 可以通过Ellman检测以及HPLC检测方法对其反应进程进行监测。
如果多肽中只含有1对Cys,那二硫键的形成是简单的。多肽经固相或液相合成,然后在pH8-9的溶液中进行氧化。
当需要形成2对或2对以上的二硫键时,合成过程则相对复杂。尽管二硫键的形成通常是在合成方案的最后阶段完成,但有时引入预先形成的二硫化物是有利于连合或延长肽链的。通常采用的巯基保护基有trt, Acm, Mmt, tBu, Bzl, Mob, Tmob等多种基团。我们分别列出两种以2-Cl树脂和Rink树脂为载体合成的多肽上多对二硫键形成路线:
二硫键反应条件选择
二硫键即为蛋白质或多肽分子中两个不同位点Cys的巯基(-SH)被氧化形成的S-S共价键。 一条肽链上不同位置的氨基酸之间形成的二硫键,可以将肽链折叠成特定的空间结构。多肽分 子通常分子量较大,空间结构复杂,结构中形成二硫键时要求两个半胱氨酸在空间距离上接近。 此外,多肽结构中还原态的巯基化学性质活泼,容易发生其他的副反应,而且肽链上其他侧链 也可能会发生一系列修饰,因此,肽链进行修饰所选取的氧化剂和氧化条件是反应的关键因素, 反应机理也比较复杂,既可能是自由基反应,也可能是离子反应。
反应条件有多种选择,比如空气氧化,DMSO氧化等温和的氧化过程,也可以采用H2O2,I2, 汞盐等激烈的反应条件。
空气氧化法: 空气氧化法形成二硫键是多肽合成中最经典的方法,通常是将巯基处于还原态的多肽溶于水中,在近中性或弱碱性条件下(PH值6.5-10),反应24小时以上。为了降低分子之间二硫键形成的可能,该方法通常需要在低浓度条件下进行。
碘氧化法:将多肽溶于25%的甲醇水溶液或30%的醋酸水溶液中,逐滴滴加10-15mol/L的碘进行氧化,反应15-40min。当肽链中含有对碘比较敏感的Tyr、Trp、Met和His的残基时,氧化条件要控制的更精确,氧化完后,立即加入维生素C或硫代硫酸钠除去过量的碘。 当序列中有两对或多对二硫键需要成环时,通常有两种情况:
自然随机成环: 序列中的Cys之间随机成环,与一对二硫键成环条件相似;
定点成环: 定点成环即序列中的Cys按照设计要求形成二硫键,反应过程相对复杂。在 固相合成多肽之前,需要提前设计几对二硫键形成的顺序和方法路线,选择不同的侧链 巯基保护基,利用其性质差异,分步氧化形成两对或多对二硫键。 通常采用的巯基保护 基有trt, Acm, Mmt, tBu, Bzl, Mob, Tmob等多种基团。
靶向多肽可以根据其功能和用途分为不同的类别。在PDC(多肽偶联药物)中,靶向多肽通常被分为细胞穿透肽和细胞靶向肽两大类。
细胞穿透肽:这类多肽能够跨越细胞膜,转运具有生物活性的大分子物质,如多肽、蛋白质、核酸等化学药物,使其顺利进入细胞。一些常见的细胞穿透肽包括Pep-1、Pentratin、PepFact14、Transportan等。
细胞靶向肽:这类多肽的作用主要是引导化学药物或生物活性分子与特定类型的细胞结合,以提高其靶向性和治疗效率。常见的细胞靶向肽包括PEGA、生长激素抑制素类似物、蛙皮素类似物、RGD肽类等。

RGD肽-说明
RGD肽是指含有由Arg-Gly-Asp三个氨基酸组成的序列多肽,有直线肽和环肽之分。它们是许多细胞外基质蛋白(如VN、FN、FGN、胶原等)等最小识别短肽序列。

研究发现,RGD序列肽具有广泛的生物活性,可用于心血管疾病、骨质疏松和炎症等疾病的治疗,还可以预防和治疗由细胞粘附异常而导致的肿瘤,尤其是发展性肿瘤的转移;另一方面,RGD 序列肽又可作为兴奋剂,促进损伤的器官与组织的再生、伤口的愈合等等,RGD作为某些整合素的受体,其选择性部分依赖于RGD的构象以及RGD周围的氨基酸残基。

为此,近几年,许多科技工作者合成了一系列RGD三肽、四肽、五肽等,还合成了RGD环肽、双线肽、RGD模拟肽等等。为了满足客户对各种RGD序列肽的需求,专肽生物提供最广泛的RGD序列肽库,以满足科研工作者对RGD肽的需求。
专肽生物提供各种RGD肽的现货,缩短科研工作者的项目时间,例如c(RGDfK)、c(RGDfC)、c(RADyK)、c(RGDyK)、c(RADfC)、环状多肽c(RGDfK)-巯基乙酸、c(RGDfK)-PEG2-巯基乙酸、Mpa-Ahx-c(RGDfK)、环状多肽c(RGDfK)-半胱氨酸、DOTA-c(RGDfK)、NOTA-c(RGDfK)、NOTA-c(RGDyK)、DOTA-c(RGDyK)、E[c(RGDfK)]2、E[c(RGDyK)]2、DDDDD-c(RGDfK)等等,具体可咨询销售人员。
细胞穿膜肽-说明
穿透细胞膜进入细胞内是许多作用靶点在细胞内的生物大分子发挥作用的先决条件,然而生物膜的生物屏障作用阻止了许多高分子物质进入细胞内,从而很大程度地限制了这些物质在治疗领域的应用。因此,如何引导这些物质穿透细胞膜是一个迫切需要解决的问题,目前介导生物大分子穿透细胞膜的方法主要包括细胞穿透肽(cell penetrating peptides,CPPs)、脂质体、腺病毒、纳米颗粒、影细胞等,而CPPs是一类以非受体依赖方式,非经典内吞方式直接穿过细胞膜进入细胞的多肽,它们的长度一般不超过30个氨基酸且富含碱性氨基酸,氨基酸序列通常带正电荷。
1型人免疫缺陷病毒转录激活因子TAT(human immunodeficiency virus-1 transcription activator, HIV-1 TAT)是第一个被发现的细胞穿透肽,它凭借一种无毒的、高效的方式进入细胞。
细胞穿透肽(cell penetrating peptides,CPPs)的一个重要特点是可以携带多种不同大小和性质的生物活性物质进入细胞,包括小分子化合物、染料、多肽、多肽核酸(peptide nucleo acid, PNA)、蛋白质、质粒DNA、siRNA、200nm的脂质体、噬菌体颗粒和超顺磁性粒子等,这一性质为其成为靶向药物的良好载体提供了可能。
CPPs作为载体的优势在于低毒性和无细胞类型的限制,尽管CPPs可输送不同类型的物质进入细胞,但其实际应用多集中于寡肽、蛋白质、寡聚核苷(oligonucleotides,ONs)或类似物的细胞转运。
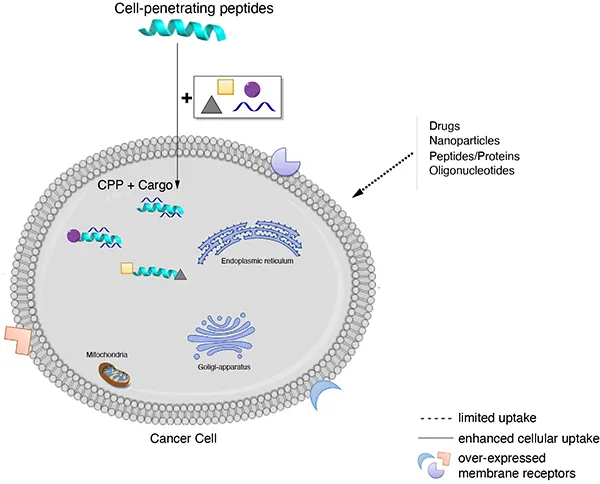
跨膜机理
不同的细胞穿透肽(CPP)跨膜机制不同,一个细胞穿透肽(CPP)的具体机制有赖于几个参数,如分子大小(携带物质)、温度、细胞类型和细胞内外的稳定性等。细胞穿透肽(CPP)进入细胞的具体机制目前还不清楚,比较流行的推测包括以下三种:
A: 倒置胶粒模型(inverted micelle model),CPPs通过细胞膜上磷脂分子的移动形成倒置胶粒结构,而进入胞浆。
B: 直接穿透,即孔隙结构模型 (pore formation model),CPPs在细胞膜上组成跨膜的孔隙结构而进入胞浆 。
C: 内吞方式进行细胞摄取。
来源: Cell-penetrating peptides and their therapeutic applications, Victoria Sebbage, BioscienceHorizons, Volume 2, Number 1, March 2009.
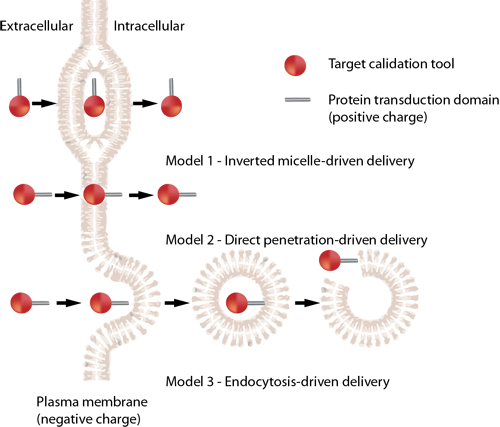
细胞穿透肽 HIV TAT
细胞穿透肽(如HIV TAT)可以以直接穿透和内吞两种方式进入细胞。HIV TAT或者简单的多聚精氨酸可被设计作为有效的药物载体,但CPP(如HIV TAT)是如何实现胞膜转运,目前仍不清楚。
简单的HIV TAT是如何促进象直接穿透和内吞作用的入胞机制的呢?来自Gerard Wong实验室的研究人员研究了在不同的条件下,HIV TAT是如何与细胞质膜、细胞骨架、特异的胞膜受体相互作用,从而诱导了多重转运途径。
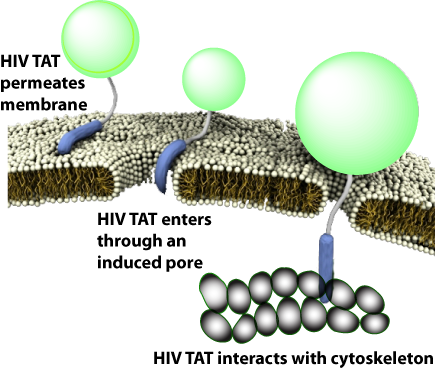
有趣的是,TAT在不同条件下可与同一序列发生多种不同的反应,因而与胞膜、细胞骨架、特异受体相互作用可产生多种转运途径。
CPP的跨膜机制与多肽序列存在很敏感的关系,如果在一个纯亲水性的CPP中增加一个疏水残基,就能彻底地改变其转运机制,例如,最简单的CPP原型-多聚精氨基(polyR),可以诱导细胞膜上形成跨膜的孔隙结构。疏水氨基酸通过插入胞膜来形成正曲率,精氨酸可同时形成正曲率和负曲率,赖氨酸只能沿一个方向形成负曲率,这就意味着在精氨酸与赖氨酸/疏水物之间存在补偿关系。
如果疏水性有助于形成负高斯曲率(Gaussian curvature),那为什么TAT肽中的疏水含量相对较低呢?其原因是CPPs都是利用尽可能少的疏水基去形成saddle-splay curvature。序列上的差异很可能只会在膜上诱导短暂的类似孔隙的跨膜结构,从而形成对CPP来说更短的孔隙寿命。由于CPP的氨基酸组成不同,TAT肽在有或无受体情况下都可以介导细胞内吞作用。
专肽生物提供各类细胞穿膜肽序列,部分由现货,例如TAT,R8,R4等,具体可咨询销售人员。
Definition
Cell permeable peptides (CPPs) are carriers with small peptide domains that can freely cross cell membranes. They are mainly used as carriers of proteins and nucleic acids into the cell1.
Discovery
The first CPP was discovered independently by two laboratories in 1988 when it was found that the trans-activating transcriptional activator (Tat) from Human Immunodeficiency Virus 1 (HIV-1) could be efficiently taken up from the surrounding media by numerous cell types in culture2.
Structural Characteristics
CPPs typically have an amino acid composition containing either a high relative abundance of positively charged, cationic amino acids such as lysine or arginine, or have sequences that contain an alternating pattern of polar/charged amino acids and non-polar, hydrophobic amino acids3. Some examples include: TAT peptide-YGRKKRRQRRR, lipid membrane translocating peptide-KKAAAVLLPVLLAAP and Antennapedia leader peptide-KKWKMRRNQFWVKVQRG.
Classification
Numerous CPPs have been identified to date and they belong to a wide variety of protein families. For example, some CPPs are amphipathic protein family members3.
Mode of action
CPPs enter the cell with their carrier by either of three mechanisms: Direct delivery that involves energy independent entry of the CPPs in to the cell4, endocytosis where the cells take up the CPPs by imbibing them with their cell membranes5 and translocation through the formation of transient structures which is yet to be understood6.
Functions
CPPs have found numerous applications in medicine as drug delivery agents in the treatment of different diseases including cancer, virus inhibitors, contrast agents for cell labeling a classical example is Green Fluorescent protein GFP, as MRI contrast agents, quantum dots7. TAT is very effective in delivering drugs in vitro and in vivo and so far a peptide that matches its efficiency has not been found7.
References
1. Wagstaff KM and David JA (2006). Protein Transduction: Cell Penetrating Peptides and Their Therapeutic Applications, Current Medicinal Chemistry, 13 (12), 1371-1387.
2. Feng S and Holland EC (1988). HIV-1 Tat trans-activation requires the loop sequence within Tar. Nature 334, 165–167.
3. Stewart KM, Horton KL, Kelley SO (2008). Cell-penetrating peptides as delivery vehicles for biology and medicine, Org Biomol Chem., 6(13), 2242-55.
4. Luo D, Saltzman WM (2000). Synthetic DNA delivery systems. Nat. Biotechnol, 18, 33-37.
5. Lundberg M., Wikstrom S and Johansson M (2003). Cell surface adherence and endocytosis of protein transduction domains, Mol. Ther., 8, 143–150.
6. Deshayes S, Gerbal-Chaloin S, Morris MC, Aldrian-Herrada G, Charnet P, Divita G (2004). On the mechanism of non-endosomial peptide-mediated cellular delivery of nucleic acids, Biochim. Biophys. Acta, 1667, 141–147.
7. Temsamani J and Vida P (2004). The use of cell-penetrating peptides for drug delivery, Drug Discovery Today, 9 (23), 1012-1019.
| DOI | 名称 | |
|---|---|---|
| 10.1038/gt.2014.52 | iRGD tumor-penetrating peptide-modified oncolytic adenovirus shows enhanced tumor transduction, intratumoral dissemination and antitumor efficacy | 下载 |
| 10.1016/j.biopha.2017.06.103 | Combination of NRP1-mediated iRGD with 5-fluorouracil suppresses proliferation, migration and invasion of gastric cancer cells | 下载 |
| 10.1155/2019/9367845 | iRGD: A Promising Peptide for Cancer Imaging and a Potential Therapeutic Agent for Various Cancers | 下载 |
| 10.1155/2014/852352 | The Effect of Superparamagnetic Iron Oxide with iRGD Peptide on the Labeling of Pancreatic Cancer Cells In Vitro: A Preliminary Study | 下载 |





